
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为____________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
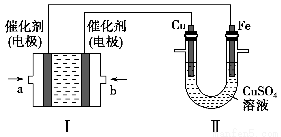
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是_________________________________________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
(1)2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=-46 kJ·mol-1
(2)①CH4 O2+2H2O+4e-=4OH- ②变小 不变 ③CO32- ④1.12
【解析】(1)根据盖斯定律,将第一个热化学方程式乘以2,与第二个相加得2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=-46 kJ·mol-1。
(2)由于Fe棒上镀Cu,则Cu棒发生氧化反应,作阳极,b电极作正极,a电极作负极,CH4在a处通入,O2在b处通入,由于KOH溶液作电解质溶液,则b极反应式为O2+2H2O+4e-=4OH-,电镀过程中电解质溶液不参与电极反应,各离子浓度均不变;CH4燃料电池中的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O,可得溶液中存在CO32-,再由电子守恒得CH4~4Cu,则12.8 g Cu的物质的量为0.2 mol,消耗CH4为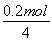 =0.05 mol,在标准状况下的体积为0.05 mol×22.4 L·mol-1=1.12 L。
=0.05 mol,在标准状况下的体积为0.05 mol×22.4 L·mol-1=1.12 L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014年高二人教版化学选修五 1-2有机化合物的结构特点练习卷(解析版) 题型:选择题
某共价化合物含C、H、N 3种元素,分子内有4个N原子,且4个N原子排列成空间的四面体(如白磷分子结构),每两个N原子间都有一个C原子,分子内无碳碳单键和碳碳双键,则该化合物分子式为( )
A.C4H8N4 B.C6H12N4 C.C6H10N4 D.C4H10N4
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题9常见金属元素及其重要化合物练习卷(解析版) 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。

已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cu2+ | 4.7 | 6.7 |
回答下列问题:
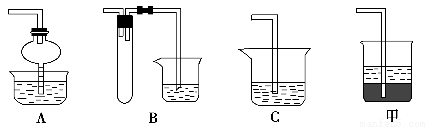
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质,用如图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式:______________________、________________________;

(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。若在实验室中用碱液吸收处理,下列A、B、C装置中可行的是________(填字母);若选用甲装置,则烧杯中的下层液体可以是________。
(3)步骤②酸浸过程中,需要用到3 mol·L-1的盐酸100 mL,配制该盐酸时。除了用到烧杯、玻璃棒、胶头滴管外,还需要用到的仪器有________________。
(4)步骤④加入物质X的目的是______________________________________,物质X可以选用下列物质中的________。
A.氧化铜 B.稀盐酸
C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行________次过滤操作。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列用品的有效成分及用途对应错误的是( )。
ABCD
用品



有效成分NaClNa2CO3Al(OH)3Ca(ClO)2
用途做调味品做发酵粉做抗酸药做消毒剂
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列物质的分类标准正确的是( )。
A.强碱和弱碱:电离出的OH-数目
B.强电解质和弱电解质:溶液的导电能力强弱
C.浊液、胶体、溶液:分散剂粒子直径大小
D.氧化剂、还原剂:在化学反应中元素的化合价变化
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:选择题
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示。则下列说法正确的是 ( )。
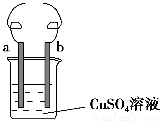
A.构成原电池时b极反应为Cu-2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b极质量可能减少也可能增加
D.构成的原电池或电解池工作后可能产生大量气体
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:选择题
常温下,0.1 mol·L-1 HX溶液的pH=1,0.1 mol·L-1 CH3COOH溶液的pH=2.9。下列说法不正确的是 ( )。
A.HX和CH3COOH均可抑制水的电离
B.取HCl与HX各0.1 mol溶于水配制成1 L混合溶液,则溶液的c(H+)=0.2 mol·L-1
C.等物质的量浓度、等体积的HX溶液与CH3COONa溶液混合后所得的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向等物质的量浓度、等体积的HX溶液和CH3COOH溶液中,分别加入一定物质的量浓度的NaOH溶液,欲使两者的pH均等于7,则消耗氢氧化钠溶液的体积:前者大于后者
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)=CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是( )。
A.1.5 mol NO2与足量的H2O反应,转移的电子数为NA
B.常温常压下,0.5NA个CO2分子质量为22 g
C.28 g氮气所含的原子数目为NA
D.在标准状况下,0.5NA个氯气分子所占体积是11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com