
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示。则下列说法正确的是 ( )。
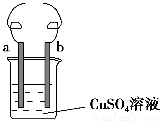
A.构成原电池时b极反应为Cu-2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b极质量可能减少也可能增加
D.构成的原电池或电解池工作后可能产生大量气体
科目:高中化学 来源:2014年高二人教版化学选修五 1-1有机化合物的分类练习卷(解析版) 题型:填空题
请根据官能团的不同对下列有机物进行分类。
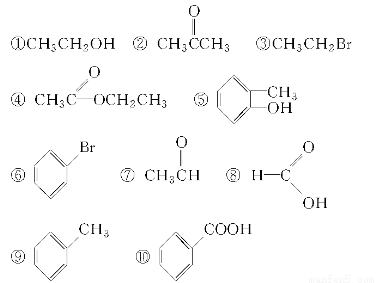
(1)芳香烃:______;(2)卤代烃:______;
(3)醇:______;(4)酚:________;(5)醛:________;
(6)酮:____________;(7)羧酸:____________;
(8)酯:______________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题9常见金属元素及其重要化合物练习卷(解析版) 题型:选择题
部分氧化的Fe?Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
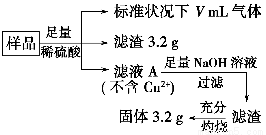
下列说法正确的是 ( )。
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列化学用语使用不正确的是( )。
A.Na+的结构示意图为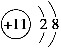
B.明矾的化学式为KAl(SO4)2·12H2O
C.聚乙烯的结构简式为CH2===CH2
D.高氯酸(HClO4)中氯元素的化合价为+7
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:填空题
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为____________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
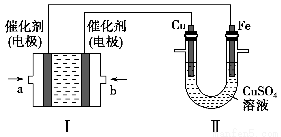
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是_________________________________________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-??H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:选择题
在Na2CO3溶液中,下列离子浓度的关系正确的是 ( )。
A.c(Na+)=2c(CO32-) B.c(H+)>c(OH-)
C.c(CO32-)<c(HCO3-) D.c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:选择题
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1
SO3(g)ΔH=-98.3 kJ·mol-1
C.SO2(g)+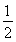 O2(g)
O2(g)  SO3(g)ΔH=+98.3 kJ·mol-1
SO3(g)ΔH=+98.3 kJ·mol-1
D.SO2(g)+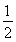 O2(g)
O2(g)  SO3(g)ΔH=-196.6 kJ·mol-1
SO3(g)ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题15有机化学基础选考练习卷(解析版) 题型:填空题
共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物,常用于有机合成,例如:
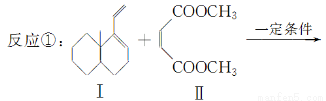
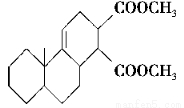
化合物Ⅱ可发生以下反应:
Ⅱ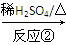 Ⅲ(分子式为C4H4O4)
Ⅲ(分子式为C4H4O4) 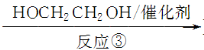 Ⅳ(高分子化合物)
Ⅳ(高分子化合物)
(1)化合物I的分子式为________,1 mol该物质完全燃烧需消耗________mol O2。
(2)反应②的化学方程式为__________________________________________。
(3)反应③是缩聚反应,化合物Ⅳ的结构简式为________。
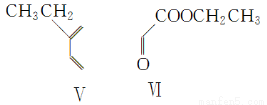
(4)在一定条件下,化合物Ⅴ和化合物Ⅵ能发生类似反应①的反应,生成两种化合物(互为同分异构体),这两种化合物的结构简式分别为________、________。
(5)下列关于化合物Ⅰ、Ⅱ、Ⅴ、Ⅵ的说法正确的有________(填字母)。
A.Ⅰ属于芳香烃
B.Ⅰ、Ⅱ、Ⅴ均能使溴的四氯化碳溶液褪色
C.Ⅴ与足量H2加成后的产物是3-甲基戊烷
D.加热条件下Ⅵ能与新制Cu(OH)2反应生成红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com