解答:
解:(1)分析可知实验室制备氯气利用二氧化锰和浓盐酸加热反应生成反应的化学方程式为:MnO
2+4HCl
MnCl
2+Cl
2↑+2H
2O;
故答案为:MnO
2+4HCl
MnCl
2+Cl
2↑+2H
2O;
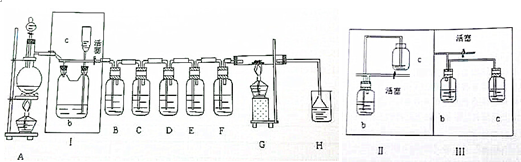
(2)利用饱和食盐水吸收氯气中的氯化氢,Ⅰ中b瓶内加入的液体最好是饱和食盐水;关闭Ⅰ中的活塞,在选取试剂正确且适量的前提下,制取氯气时c中的液面不明显上升,估计可能的原因是A装置漏气,检查原因的简单方法是:分液漏斗中液体滴下时全部流下说明漏气,检验这一部分装置的气密性方法为:关闭分液漏斗旋塞和Ⅰ处活塞,从C中向容器内加水,当C的下端浸入液面下且C中液面高于b瓶内液面,静置观察,若液面不下降,说明气密性良好;
故答案为:饱和食盐水;A装置漏气,分液漏斗中液体滴下时全部流下说明漏气,关闭分液漏斗旋塞和Ⅰ处活塞,从C中向容器内加水,当C的下端浸入液面下且C中液面高于b瓶内液面,静置观察,若液面不下降,说明气密性良好;
(3)Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,不能气体流通;
故答案为:Ⅱ可行,Ⅲ不行.Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,体积不能改变,增大压强会有危险;
(4)a氯气是黄绿色气体,观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置;
故答案为:观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置;
b氯气通过B为硫化氢溶液,发生氧化还原反应生成硫单质,C溴化亚铁溶液氧化亚铁离子和溴离子为铁离子,溶液由浅绿色变为深红棕色;通入D碘化钾淀粉溶液生成碘单质遇淀粉变蓝;通入E混有二氧化硫的氯化钡溶液,氧化二氧化硫为硫酸,生成白色沉淀,F是提供水蒸气,氯气溶解于水中,溶液呈淡黄绿色;
故答案为:淡黄色沉淀,溶液由浅绿色变为深红棕色;溶液变蓝;生成白色沉淀,水溶液呈淡黄绿色;
(5)G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,结合原子守恒写出化学方程式为:C+2H
2O+2Cl
2═CO
2↑+4HCl↑;F为G提供水蒸气的作用;
故答案为:C+2H
2O+2Cl
2═CO
2↑+4HCl↑;向G中提供反应所需的水蒸气;
(6)H为紫色石蕊试液通入氯气生成盐酸和次氯酸使石蕊试液变红,次氯酸具有漂白作用褪色;
故答案为:生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去;
(7)G中气体成分为二氧化碳和氯化氢,二者物质的量为1:4,氯化氢先于二氧化碳反应,所以不会产生沉;
故选B.
(8)为了防止氯气外溢,关闭Ⅰ处活塞,气体压强增大,b 瓶内液面下降,c处液面上升,起到储气作用;
故答案为:关闭Ⅰ处活塞,b 瓶内液面下降,c处液面上升,起到储气作用;
(9)氯气与水反应的化学方程式:Cl
2+H
2O=HCl+HClO
①盐酸和次氯酸具有酸性,能够与氢氧化钠发生中和反应,酚酞在碱性环境下才显红色;次氯酸具有漂白性,也可能使红色的酚酞变红色,
②氯水中的次氯酸将变红的酚酞漂白了;
要证明红色褪去的原因是①或②可以通过以下实验:在已经褪色的溶液中继续加入NaOH溶液,直至溶液呈碱性,若溶液恢复红色,则说明是碱性被中和导致褪色①正确,反之,则是被漂白了②正确;
故答案为:氯水将NaOH溶液的碱性中和了;氯水中的次氯酸将变红的酚酞漂白了;
在已经褪色的溶液中继续加入NaOH溶液,直至溶液呈碱性,若溶液恢复红色,则说明是碱性被中和导致褪色①正确,反之,则是被漂白了②正确.
(10)C中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO
3,其物质的量比为2:1,依据氧化还原反应中:氯元素化合价升高,Cl
2~2NaClO~2e
-;Cl
2~NaClO
3~5e
-,氯元素化合价降低,Cl
2~Cl
-~e
-,依据电子守恒得到,电子转移7mol电子,所以做氧化剂的氯气为7mol,还原剂为3mol,所以参加反应的氧化剂和还原剂的物质的量比为7:3,
故答案为:7:3.



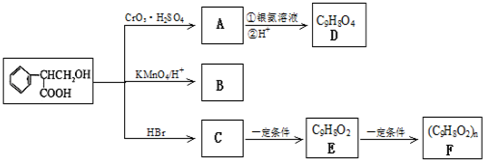
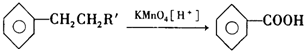
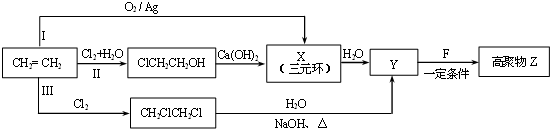
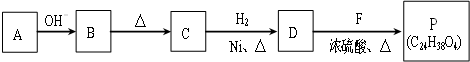
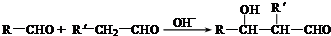 (R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.