
【题目】在带有活塞的密闭容器中发生反应:Fe2O3+3H2=2Fe+3H2O(g),采取下列措施能改变反应速率的是( )
A. 增加Fe2O3的量 B. 保持容器体积不变,增加H2输入量
C. 减少Fe的量 D. 保持容器体积不变,增加H2O(g)
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

已知:
Ⅰ. ![]()
Ⅱ. ![]() (苯胺、易被氧化)
(苯胺、易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子式是__________;C的名称是___________。
(2)H的结构简式是_____________。
(3)反应②、④的类型是__________。
(4)反应⑤的化学方程式是____________;
(5) 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_______种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_______种。
(6)请用合成反应流程图表示出由A和其他无机物(溶剂任选)合成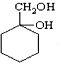 最合理的方案。
最合理的方案。
示例如下:

____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中说明乙醇作为燃料的优点的是
①燃烧时只发生氧化反应 ②充分燃烧的产物不污染环境③乙醇是一种再生能源 ④燃烧时放出大量的热
A. ②③ B. ②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③________________________。
(3)若pH过高,则对产品的影响是________________________。
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下),并测得溶液中含有0.02 mol Al3+。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(1)用双桥法标电子转移 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O:________________。
(2)此反应中还原剂与氧化剂的物质的量之比为:___________,生成标准状态下2.24 L 气体时转移电子_________________个。
(3)在足量铜片中加入一定量稀硝酸,开始一段时间冒出气泡的速率很慢,后来变快了,原因是__________________________________________。
(4)在过量铜片中加入一定量稀硝酸,反应结束后,再加入一些稀硫酸,又有NO气体冒出,请写出加硫酸后反应的离子方程式:______________________________________。
(5)已知一定量的铁粉与稀硝酸反应生成1 mol Fe(NO3)3 和 3 mol Fe(NO3)2 ,则生成NO气体______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烷烃的混合物,在标准状况下其密度为1.03 g·L-1 ,则关于该混合物组
成的说法正确的是( )
A. 一定有甲烷 B. 一定有乙烷
C. 不可能是甲烷和乙烷的混合物 D. 可能是乙烷和丙烷的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支25 mL的酸式滴定管中盛入0.1 mo1·L-1HCl溶液,其液面恰好在5 mL的刻度处。若把滴定管中的溶液全部放入锥形瓶中,然后以0.1 mo1·L-1NaOH溶液进行中和,则所需NaOH溶液的体积
A.等于20mLB.大于20mLC.小于20mLD.等于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是( )
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
C. 制铁:以铁矿石为原料,CO还原得铁
D. 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com