
ЁОЬтФПЁПвбжЊЃК3Cu + 8HNO3 = 3Cu(NO3)2 + 2NOЁќ + 4H2O
ЃЈ1ЃЉгУЫЋЧХЗЈБъЕчзгзЊвЦ 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NOЁќ + 4H2OЃК________________ЁЃ
ЃЈ2ЃЉДЫЗДгІжаЛЙдМСгыбѕЛЏМСЕФЮяжЪЕФСПжЎБШЮЊЃК___________ЃЌЩњГЩБъзМзДЬЌЯТ2.24 L ЦјЬхЪБзЊвЦЕчзг_________________ИіЁЃ
ЃЈ3ЃЉдкзуСПЭЦЌжаМгШывЛЖЈСПЯЁЯѕЫсЃЌПЊЪМвЛЖЮЪБМфУАГіЦјХнЕФЫйТЪКмТ§ЃЌКѓРДБфПьСЫЃЌдвђЪЧ__________________________________________ЁЃ
ЃЈ4ЃЉдкЙ§СПЭЦЌжаМгШывЛЖЈСПЯЁЯѕЫсЃЌЗДгІНсЪјКѓЃЌдйМгШывЛаЉЯЁСђЫсЃЌгжгаNOЦјЬхУАГіЃЌЧыаДГіМгСђЫсКѓЗДгІЕФРызгЗНГЬЪНЃК______________________________________ЁЃ
ЃЈ5ЃЉвбжЊвЛЖЈСПЕФЬњЗлгыЯЁЯѕЫсЗДгІЩњГЩ1 mol FeЃЈNO3)3 КЭ 3 mol FeЃЈNO3)2 ЃЌдђЩњГЩNOЦјЬх______molЁЃ
ЁОД№АИЁП 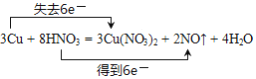 3:2 0.3NA ДЫЗДгІЗХШШЮТЖШЩЯЩ§ЃЌЫйТЪМгПь 3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NOЁќ + 4H2O 3
3:2 0.3NA ДЫЗДгІЗХШШЮТЖШЩЯЩ§ЃЌЫйТЪМгПь 3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NOЁќ + 4H2O 3
ЁОНтЮіЁП(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NOЁќ + 4H2OЗДгІжаCuЛЏКЯМлгЩ0МлЩ§ИпЕН+2МлЃЌNгЩ+5МлНЕЕЭЕН+2МлЃЌзЊвЦЕчзгЪ§3ЁС2=6ЃЌгУЫЋЯпЧХЗЈБэЪОЕчзгЕФзЊвЦЃЌБэДяЪНЮЊЃК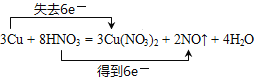 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК ЃЛ
ЃЛ
(2)ЗДгІжаCuЛЏКЯМлгЩ0МлЩ§ИпЕН+2МлЃЌCuЮЊЛЙдМСЃЌNгЩ+5МлНЕЕЭЕН+2МлЃЌЯѕЫсЮЊбѕЛЏМСЃЌЦфжабѕЛЏМСжЛга2ЗнЃЌвђДЫЛЙдМСгыбѕЛЏМСЕФЮяжЪЕФСПжЎБШЮЊ3:2ЃЌБъзМзДЬЌЯТ2.24 L ЦјЬхЕФЮяжЪЕФСПЮЊ0.1molЃЌИљОн(1)ПЩжЊЃЌзЊвЦЕчзг0.3NAИіЃЌЙЪД№АИЮЊЃК3:2ЃЛ0.3NAЃЛ
(3)ЭгыЯЁЯѕЫсЕФЗДгІЪЧЗХШШЗДгІЃЌЫцзХЗДгІЕФНјааЃЌШмвКЕФЮТЖШж№НЅЩ§ИпЃЌЗДгІЫйТЪж№НЅМгПьЃЌЙЪД№АИЮЊЃКДЫЗДгІЗХШШЮТЖШЩЯЩ§ЃЌЫйТЪМгПьЃЛ
(4)ЭгыЯЁЯѕЫсЗДгІЩњГЩСЫЯѕЫсЭЃЌдкШмвКжадйМгШывЛаЉЯЁСђЫсЃЌШмвКжагжаЮГЩСЫЯѕЫсЃЌМЬајгыЭЗДгІЃЌвђДЫгжгаNOЦјЬхУАГіЃЌЗДгІЕФРызгЗНГЬЪНЮЊ3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NOЁќ + 4H2OЃЌЙЪД№АИЮЊЃК3Cu + 8H+ +2NO3 - = 3Cu2+ + 2NOЁќ + 4H2OЃЛ
(5)вЛЖЈСПЕФЬњЗлгыЯЁЯѕЫсЗДгІЩњГЩ1 mol Fe(NO3)3 КЭ 3 mol Fe(NO3)2 ЃЌзЊвЦЕФЕчзгЮЊ1molЁС3+3molЁС2=9molЃЌвђДЫЩњГЩЕФNOЕФЮяжЪЕФСП=![]() =3molЃЌЙЪД№АИЮЊЃК3ЁЃ
=3molЃЌЙЪД№АИЮЊЃК3ЁЃ


 ЬиИпМЖНЬЪІЕуВІЯЕСаД№АИ
ЬиИпМЖНЬЪІЕуВІЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаПЯЖЈВЛКЌгаРызгМќЕФЪЧ(ЁЁЁЁ)
A. бѕЛЏЮя B. ЧПЫс C. ЧПМю D. бЮРр
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІжаЩњГЩЮяЕФзмФмСПИпгкЗДгІЮяЕФзмФмСПЕФЪЧ
A. ZnгыЯЁСђЫсЗДгІЗХГіЧтЦј B. ЫсМюжаКЭЗДгІ.
C. СђдкПеЦјжаШМЩе D. Ba(OH)2ЁЄ8H2OгыNH4ClЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіжае§ШЗЕФЪЧ(ЁЁЁЁ)
A. жмЦкБэжа0зхдЊЫиЕФЕЅжЪГЃЮТГЃбЙЯТОљЮЊЦјЬх
B. жмЦкБэжаКЌдЊЫижжРрзюЖрЕФзхЮЊЂјзх
C. ЫљгажїзхдЊЫиОљдкЖЬжмЦкжа
D. ЕкnжмЦкnжїзхЕФдЊЫиОљЮЊЗЧН№ЪєдЊЫи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкДјгаЛюШћЕФУмБеШнЦїжаЗЂЩњЗДгІЃКFe2O3+3H2=2Fe+3H2OЃЈgЃЉЃЌВЩШЁЯТСаДыЪЉФмИФБфЗДгІЫйТЪЕФЪЧЃЈ ЃЉ
A. діМгFe2O3ЕФСП B. БЃГжШнЦїЬхЛ§ВЛБфЃЌдіМгH2ЪфШыСП
C. МѕЩйFeЕФСП D. БЃГжШнЦїЬхЛ§ВЛБфЃЌдіМгH2OЃЈgЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗжРыЗНЗЈжаЃЌКЭЮяжЪЕФШмНтЖШЮоЙиЕФЪЧ
A. Щ§ЛЊ B. нЭШЁ C. жНВуЮі D. НсОЇ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ЮяжЪЗЂЩњЛЏбЇБфЛЏЖМАщЫцзХФмСПБфЛЏ
B. ШЮКЮЗДгІжаЕФФмСПБфЛЏЖМБэЯжЮЊШШСПБфЛЏ
C. АщгаФмСПБфЛЏЕФЮяжЪБфЛЏЖМЪЧЛЏбЇБфЛЏ
D. УЛгаЮяжЪЕФБфЛЏЃЌОЭВЛЛсгаФмСПЕФБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќйЄЕТТоГЃЪ§ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. БъзМзДПіЯТЃЌ22.4LCH4жаКЌгаЧтдзгЪ§ФПЮЊ4NA
B. 1molNa2O2жаКЌгаЕФвѕРызгКЭбєРызгЕФЪ§ФПЖМЪЧ2NA
C. 0.1mol/LCu(NO3)2ШмвКжаКЌгаЕФNO3ЃЪ§ФПЮЊ0.2NA
D. 28gN2жаЫљКЌЕФдзгЪ§ФПЪЧNA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№ЪіжаДэЮѓЕФЪЧЃЈ ЃЉ
A. ЯћГ§ЩЂТфдкЕиУцЕФЙЏжщЕФЗНЗЈЪЧШіЩЯСђЗл
B. ЭЫПВСССКѓЩьШыСђеєЦјжаВњЮяЪЧCuS
C. ПЩвдгУCS2НўХнЕФЗНЗЈГ§ШЅИНдкВЃСЇЦїУѓЩЯЕФСђ
D. ПЩвдгУМгШШХЈNaOHШмвКЕФЗНЗЈГ§ШЅИНдкЪдЙмФкБкЩЯЕФСђ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com