
分析 (1)根据m=cVM计算需要氯化钠的质量;
(2)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,根据配制一定物质的量浓度的溶液步骤解答.
解答 解:(1)需要氯化钠的质量为:2mol/L×0.1L×58.5g/mol=11.7g,
故答案为:11.7;
(2)②配制100mL溶液需要选用规格为100mL的容量瓶,所以将所得溶液冷却至室温后,沿玻璃棒小心转入100mL容量瓶;
③转移溶液后小于洗涤烧杯和玻璃杯,即用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中;
④定容:继续加蒸馏水至液面距刻度线1~2 cm处,然后改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切,
故答案为:100 mL;洗涤烧杯和玻璃棒;溶液凹液面最低处与刻度线相切.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,明确配制步骤为解答关键,试题侧重基础知识的考查,有利于提高学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸水溶液的pH<7:H2SO3?2H++SO32- | |
| B. | 将亚硫酸滴入饱和Na2CO3溶液有气泡产生:2H++CO32-═H2O+CO2↑ | |
| C. | Na2SO3溶液能使红色石蕊变蓝:SO32-+H2O═HSO3-+OH- | |
| D. | Na2SO3溶液中加入足量的酸化Ba(NO3)2溶液出现白色沉淀:3SO32-+2NO3-+2H++3Ba2+═3BaSO4↓+2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作和现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中有白色沉淀生成 | 白色沉淀是BaSO3 |
| B | 向某待检液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该待检液中可能不含有SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+>Br2>I2 |
| D | 向浓度均为0.1mol/L的KCl、KI混合液中滴加1~2滴0.01mol/LAgNO3溶液,产生黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2 | |
| B. | 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2 | |
| C. | 向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2可以与盐发生置换反应 | |
| D. | 新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+ |
查看答案和解析>>
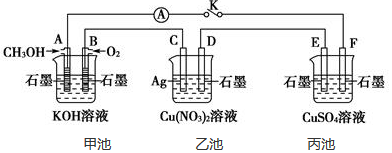
科目:高中化学 来源: 题型:选择题

| A. | 甲中负极反应式为Ag++e-═Ag | |
| B. | 丙中H+向碳棒方向移动 | |
| C. | 乙中阳极反应式为2H++2e-═H2↑ | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
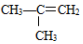 ②
②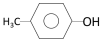 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )
;④CH3CH2Cl;⑤CCl4;⑥CH3C≡CH;⑦HOCH2CH2OH;⑧CH3CH2OH;根据官能团的不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 7类 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A.反应①的平衡常数K1=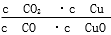
B.反应③的平衡常数K=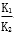
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com