
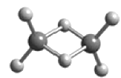
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,它们分别位于三个不同的周期。常温下,元素W与X可形成两种液态物质;Y、Z两种元素可组成二聚气态分子(如图所示),其中Y原子的最外层电子数等于其电子层数。下列叙述不正确的是( )
A.W与Z具有相同的负化合价
B.四种元素的简单离子半径由大到小的顺序:Z>Y>X>W
C.Y2Z6分子中所有原子的最外层均满足8电子稳定结构
D.工业上可电解X与Y形成的熔融化合物制取Y的单质
【答案】B
【解析】
“W、X、Y、Z为原子序数依次增大的短周期主族元素,它们分别位于三个不同的周期”,由此可推出W为氢元素(H);由“元素W与X可形成两种液态物质”,可推出X为氧(O)元素;由“Y原子的最外层电子数等于其电子层数”,可推出Y为第三周期元素铝(Al);由“Y、Z两种元素可组成二聚气态分子”结构,可确定Z与Al反应表现-1价,则其最外层电子数为7,从而确定Z为氯(Cl)元素。
A.W(H)与Z(Cl)在与活泼金属的反应中,都可表现出-1价,A正确;
B.四种元素的简单离子半径由大到小的顺序为Cl->O2->Al3+>H+,B不正确;
C.Al2Cl6分子中,由于有2个Cl原子分别提供1对孤对电子与2个Al原子的空轨道形成配位键,所有原子的最外层均满足8电子稳定结构,C正确;
D.工业上制取金属铝(Al)时,可电解熔融的Al2O3,D正确;
故选B。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化以及化学键的断裂和形成来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化以及化学键的断裂和形成来表示。下列各关系中能说明反应已达到平衡状态的是
A.2v正(H2)=3v逆(NH3)
B.3v正(N2)=v正(H2)
C.1 mol N≡N键断裂的同时,有3 mol H-H键断裂
D.1 mol N≡N键形成的同时,有6 mol N-H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1Na2S溶液中存在着水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大
B.通入NH3,平衡正向移动
C.滴加少量AgNO3溶液,平衡逆向移动
D.升高温度,c(HS-)/c(S2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
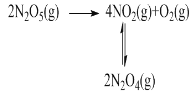
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解)
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() =2.9 kPa,则此时的
=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述正确的是( )
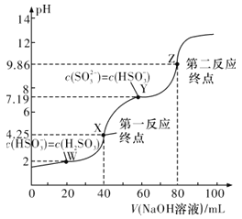
A.SO32-水解常数Kh的数量级为10-8
B.若滴定到第一反应终点,可用酚酞作指示剂
C.图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D.图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日消息,诺贝尔化学奖颁给约翰●B.古迪纳夫、M●斯坦利●威廷汉和吉野彰,以表彰他们“开发锂离子电池”的贡献。磷酸亚铁锂(化学式:LiFePO4)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为__;基态磷原子第一电离能比基态硫的__(填“大”或“小”),原因是__。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是__,其中硫、碳的杂化类型分别是__、__。
(3)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为__;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为__。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
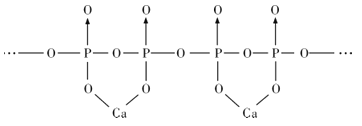
由图推知该多磷酸钙盐的通式为__。
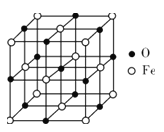
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__,Fe2+与O2-最短核间距为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
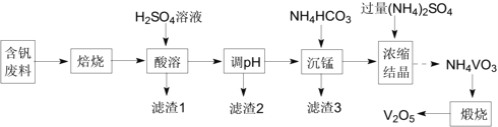
【题目】五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含V2O3、CuO、MnO、SiO2、Al2O3、有机物
含V2O3、CuO、MnO、SiO2、Al2O3、有机物![]() 为原料制备V2O5的一种流程如图:
为原料制备V2O5的一种流程如图:
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
Ksp | 2.2×10-20 | 4×10-14 | 1.9×10-33 |
(1)“焙烧”的目的是__;
(2)“滤渣1”的用途为__![]() 写出2种即可
写出2种即可![]() ;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__
;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全
溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为__;
(4)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为__;
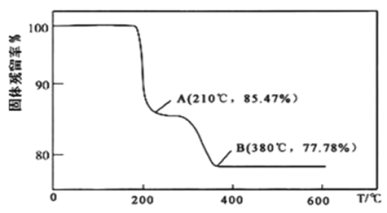
(5)在煅烧NH4VO3生成的V2O5过程中,固体残留率(![]() ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。![]() 填写分子式
填写分子式![]()
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入足量稀硫酸使其完全反应,生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+黄色![]() 被还原为VO2+蓝色
被还原为VO2+蓝色![]() ,该反应的离子方程式为__;该产品的纯度为__。
,该反应的离子方程式为__;该产品的纯度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
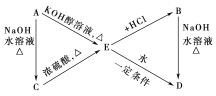
【题目】已知:R—CH=CH2+HX→![]() (主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(主要产物)。下列转化中A、B分别是分子式为C3H7Cl的两种同分异构体,请根据转化关系和反应条件,判断并写出:
(1)A、B、C、D、E的结构简式____、____、____、____、____。
(2)由E转化为B、由A转化为E的化学方程式____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用有机物苯实现电化学储氢的原理如下图所示。下列说法中不正确的是( )
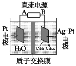
A.Ag-Pt极的电极反应式为:C6H6+6H++6e-== C6H12
B.总反应式为2C6H6+6H2O→2C6H12+3O2↑
C.通电后H+离子由左池向右池迁移
D.当电路中通过1mol电子的电量时,会有0.25molO2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com