
【题目】2019年10月9日消息,诺贝尔化学奖颁给约翰●B.古迪纳夫、M●斯坦利●威廷汉和吉野彰,以表彰他们“开发锂离子电池”的贡献。磷酸亚铁锂(化学式:LiFePO4)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为__;基态磷原子第一电离能比基态硫的__(填“大”或“小”),原因是__。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是__,其中硫、碳的杂化类型分别是__、__。
(3)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为__;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为__。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
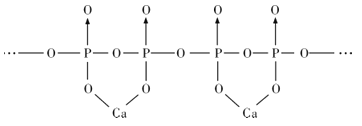
由图推知该多磷酸钙盐的通式为__。
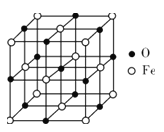
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__,Fe2+与O2-最短核间距为___pm。
【答案】球形 大 磷原子的3p轨道半充满,较稳定 K2[Fe(SCN)5] sp3 sp 正四面体  或
或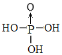 (CaP2O6)n 6
(CaP2O6)n 6 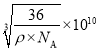
【解析】
(1)锂是3号元素,基态锂原子核外能量最高的电子位于2s轨道;基态磷原子3p轨道上电子半充满,电子的能量低,第一电离能反常。
(2) FeCl3与KSCN溶液混合,可得到配位数为5的配离子为[Fe(SCN)5]2-,再依据电荷守恒,配上2个K+,从而得出其化学式,依据其中硫、碳的价层电子对数,确定杂化类型。
(3) PO43-的空间构型为AB4型结构;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3为二元酸,分子中含有2个-OH,由此写出结构式。
(4)由图找出结构单元,从而推知该多磷酸钙盐的通式。
(5)从晶胞中找到位于中心的一个O2-,然后寻找等距离的Fe2+数目。可从一个小立方体中进行计算,在小立方体中,含有![]() 个“FeO”,则由密度可计算其体积,从而求出Fe2+与O2-最短核间距。
个“FeO”,则由密度可计算其体积,从而求出Fe2+与O2-最短核间距。
(1)基态锂原子核外能量最高的电子所在的电子云为2s,其轮廓图形状为球形;基态磷原子价电子排布为3s23p3,P轨道电子半充满,能量低,第一电离能出现反常,所以比基态硫的大,原因是磷原子的3p轨道半充满,较稳定。答案为:球形;大;磷原子的3p轨道半充满,较稳定;
(2) FeCl3与KSCN溶液混合,可得到配位数为5的配离子为[Fe(SCN)5]2-,再依据电荷守恒,配上2个K+,从而得出其化学式K2[Fe(SCN)5],其中硫、碳的价层电子对数分别为4、2,杂化类型分别是sp3、sp。答案为:K2[Fe(SCN)5];sp3;sp;
(3) PO43-的结构式中,P原子周围有4个O原子,构成AB4型结构,所以空间构型为正四面体;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3为二元酸,分子中含有2个-OH,从而得出H3PO3的结构式为 或
或 。答案为:正四面体;
。答案为:正四面体; 或
或 ;
;
(4)由图推知,其结构单元为 ,该多磷酸钙盐的通式为(CaP2O6)n。答案为:
,该多磷酸钙盐的通式为(CaP2O6)n。答案为: ;
;
(5)从晶胞中找到位于中心的一个O2-,在其周围等距离的Fe2+数目为6。可从一个小立方体中进行计算,在小立方体中,含有![]() 个“FeO”,设Fe2+与O2-最短核间距为a,则a3=
个“FeO”,设Fe2+与O2-最短核间距为a,则a3=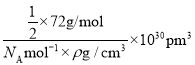 ,从而求出a=
,从而求出a=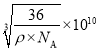 。答案为:
。答案为: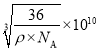 。
。


科目:高中化学 来源: 题型:
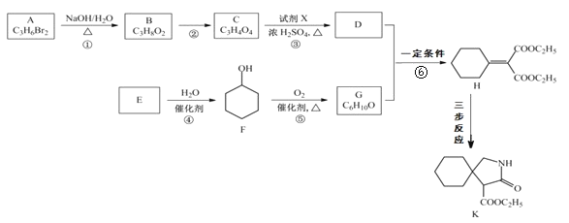
【题目】有机物 K 是某药物的中间体,合成路线如图所示:
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。
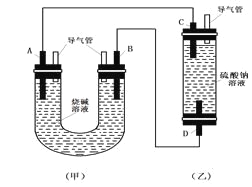
(1)从装置的特点判断,甲、乙装置中___________是原电池,其负极的电极反应式为:_______________;
(2)实验开始后,(乙)装置中有关电极反应是:C:___________________;D:__________________,D电极上的现象是_____________,一段时间后溶液中的现象是________________;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为:__________________,乙装置里除两电极上有明显的现象外,还可以看到的现象是__________________,产生该现象的化学反应方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.含1mol/LC1-的NH4Cl与氨水的中性混合溶液中,NH4+数为NA
B.60gSiO2和28gSi中各含有4NA个Si-O键和4NA个Si-Si键
C.标准状况下,浓盐酸分别与MnO2、KClO3反应制备22.4LCl2,转移的电子数均为2NA
D.10g46%甲酸(HCOOH)水溶液所含的氧原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,它们分别位于三个不同的周期。常温下,元素W与X可形成两种液态物质;Y、Z两种元素可组成二聚气态分子(如图所示),其中Y原子的最外层电子数等于其电子层数。下列叙述不正确的是( )
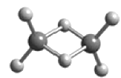
A.W与Z具有相同的负化合价
B.四种元素的简单离子半径由大到小的顺序:Z>Y>X>W
C.Y2Z6分子中所有原子的最外层均满足8电子稳定结构
D.工业上可电解X与Y形成的熔融化合物制取Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
A.溴水B.NaOH溶液C.Na2SO4溶液D.KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是
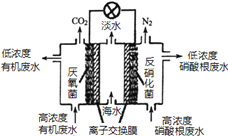
A. 该电池能在高温下工作
B. 该电池工作时,中间室中的Cl-移向右室
C. 正极上发生的电极反应:2NO3-+ 6H2O + 10e-═ N2 ↑+ 12OH-
D. 若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6 转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mL 0.10 mol/L 硫酸加水稀释成 2 L 溶液,则溶液中由水电离产生的H+ 的浓度为( )
A.1×10-10 mol/L
B.1×10-8 mol/L
C.1×10-11 mol/L
D.1×10-4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
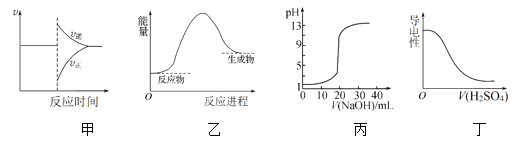
A. 图甲表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C. 图丙表示0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D. 图丁表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com