
【题目】如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。
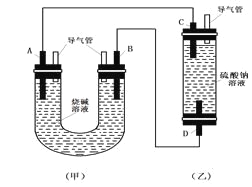
(1)从装置的特点判断,甲、乙装置中___________是原电池,其负极的电极反应式为:_______________;
(2)实验开始后,(乙)装置中有关电极反应是:C:___________________;D:__________________,D电极上的现象是_____________,一段时间后溶液中的现象是________________;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为:__________________,乙装置里除两电极上有明显的现象外,还可以看到的现象是__________________,产生该现象的化学反应方程式是______________。
【答案】甲 Al-3e-+4OH-=AlO2-+2H2O Fe-2e-=Fe2+ 2H++2e-=H2↑ 有无色气体产生 有白色沉淀生成 4OH--4e-=2H2O+O2↑ 白色沉淀转化为灰绿色,最后呈现红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
(1)甲为原电池,乙为电解质,甲中A为正极,B为负极,正极发生还原反应,负极发生氧化反应;
(2)C为阳极,发生氧化反应,D为阴极,发生还原反应;
(3)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,则D为阳极,C为阴极,阳极生成氧气,阴极生成氢气,氧气可与氢氧化亚铁发生氧化还原反应生成红褐色氢氧化铁。
(1)A、D均为碳棒,B为铝棒,C为铁棒,铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,所以甲为原电池,乙为电解质,甲中A为正极,B为负极,负极发生氧化反应,电极方程式为Al-3e-+4OH-=AlO2-+2H2O;
(2)乙是电解池,其中C为阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+;D为阴极,发生还原反应,电极方程式为2H++2e-=H2↑。氢离子放电破坏水的电离平衡,所以阴极附近溶液碱性增强,所以则可生成氢氧化亚铁白色沉淀,则一段时间后溶液中的现象是有无色气体产生,有白色沉淀生成;
(3)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,则D为阳极,C为阴极,阳极生成氧气,电极方程式为4OH--4e-=2H2O+O2↑;阴极生成氢气,氧气可与氢氧化亚铁发生氧化还原反应生成红褐色氢氧化铁,可观察到白色沉淀迅速变为灰绿色,最后变为红褐色,产生该现象的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3。
【点晴】
电极产物的判断与有关反应式的书写
1、电解时电极产物的判断——“阳失阴得”,即
 。
。
2、电解池中电极反应式的书写
(1)根据装置书写
①根据电源确定阴、阳两极→确定阳极是否是活性金属电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
②在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
(2)由氧化还原反应方程式书写电极反应式
①找出发生氧化反应和还原反应的物质→两极名称和反应物→利用得失电子守恒分别写出两极反应式。
②若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式即得另一电极反应式。


科目:高中化学 来源: 题型:
【题目】下列化学用语,应用正确的是 ( )
A.硝基苯的结构简式是:![]()
B.乙炔的电子式是:![]()
C.乙醚分子的球棍模型是: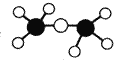
D.甲酸中存在一CHO和—COOH两种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种一元酸溶液各1mL, 分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示, 则下列说法正确的是

A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a = 5时, A是弱酸, B是强酸
D. 若A、B都是弱酸, 则5 > a > 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒容的条件下对于N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1Na2S溶液中存在着水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大
B.通入NH3,平衡正向移动
C.滴加少量AgNO3溶液,平衡逆向移动
D.升高温度,c(HS-)/c(S2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
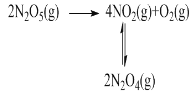
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解)
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() =2.9 kPa,则此时的
=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
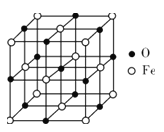
【题目】2019年10月9日消息,诺贝尔化学奖颁给约翰●B.古迪纳夫、M●斯坦利●威廷汉和吉野彰,以表彰他们“开发锂离子电池”的贡献。磷酸亚铁锂(化学式:LiFePO4)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为__;基态磷原子第一电离能比基态硫的__(填“大”或“小”),原因是__。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是__,其中硫、碳的杂化类型分别是__、__。
(3)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为__;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为__。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
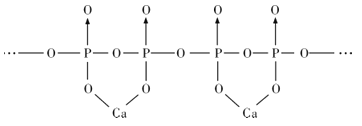
由图推知该多磷酸钙盐的通式为__。
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__,Fe2+与O2-最短核间距为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol·L-1KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
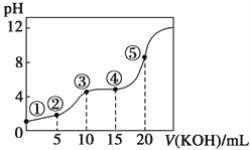
(1)点①所示溶液中,Kw=__________。
(2)点②所示溶液中的电荷守恒式为______________________________________。
(3)点③所示溶液中存在________种平衡。
(4)点④所示溶液中的物料守恒式为0.10 mol·L-1=___________________________。
(5)点⑤所示溶液中各离子浓度的大小顺序为________________________________。
(6)上述5点所示溶液中,水的电离程度最大的是_______,最小的是________(用序号回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com