
【题目】下列图示与对应的叙述相符合的是
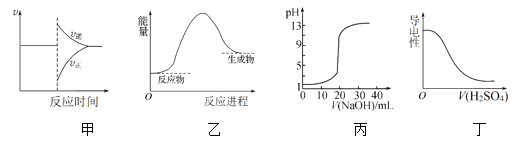
A. 图甲表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C. 图丙表示0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D. 图丁表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-![]() FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是
FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是

A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
请回答下列问题:
(1)已知热化学方程式:CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
(2)水解反应达到平衡后,若减小容器的体积,则逆反应速率_______________(填“增大”、“减小”或“不变”,下同),COS的转化率_______________。
(3)COS氢解反应的平衡常数K与温度T具有如下的关系式![]() (a、b均为常数)
(a、b均为常数)
①如图能表示COS的氢解反应的直线为____________。
②一定条件下,催化剂Ⅰ和Ⅱ对COS氢解反应的催化作用如下:
达到平衡所需时间/min | a 的数值 | b的数值 | |
催化剂Ⅰ | t | a1 | b1 |
催化剂Ⅱ | 2t | a2 | b2 |

则a1_______________a2 (填“>”、“<”、“=”)。
(4)某温度下,维持体系体积恒定,物质的量分别为m、n的COS蒸气和H2发生氢解反应。已知COS的平衡转化率为α,则在该温度下反应的平衡常数K=________(用m、n、α等符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素B的核电荷数为Z,已知Bn﹣和Am+的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为( )
A.Z+n﹣m
B.Z+m+n
C.Z﹣n﹣m
D.Z﹣n+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化通常通过取代反应实现的是:
A. CH3CH2OH → CO2 B. CH3CH2OH → CH3CHO
C. CH2=CH2 → CH3CH2OH D. CH3COOH → CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池在碱性环境下的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。已知:电池的“理论比能量”指单位质量电极材料理论上释放出的最大电能。下列说法不正确的是( )
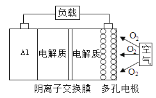
A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属-空气电池,Al-空气电池的理论比能量最高
C. M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 消耗氧气22.4 L(标准状况),有4 molOH-从右往左通过阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述中正确的是( )
A.若氯气发生泄漏,应立即向下风地区转移
B.氯气、氯水和液氯是同一种物质
C.氯气不能溶于水,所以可用排水法收集
D.用管子把氯气通入老鼠洞中可以灭鼠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、Q、R.、W原子序数依次增大,其组成物质可进行下列转化:金属单质A与气体单质B加热反应生成M,M具有硬度高、耐高温等特点,易与常见液体D反应,生成刺激性气味气体E能使湿润的红色石蕊试纸变蓝 。A不溶于碱溶液但可与E在加热条件下反应得到M。下列说法正确的是
A. 化合物M是一种新型无机非金属材料氮化铝
B. Q元素组成的单质常温下较稳定
C. R元素组成的单质A又称作“国防金属”
D. A与E反应中,每生成0.1molM可得气态产物3.36L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com