
【题目】下列关于氯气的叙述中正确的是( )
A.若氯气发生泄漏,应立即向下风地区转移
B.氯气、氯水和液氯是同一种物质
C.氯气不能溶于水,所以可用排水法收集
D.用管子把氯气通入老鼠洞中可以灭鼠
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA)是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期在医学上使用,作手术缝合线及骨钉等,现在则已较广泛应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出的淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米秸秆、麦秆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为___________________________________________。
(2)已知1 mol葡萄糖![]() 2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8 g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
②另取1.8 g乳酸与过量的金属钠反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
由实验数据推知乳酸分子含有________(填官能团名称),从以上条件推知乳酸的结构简式可能为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
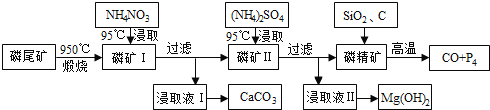
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________(填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________(填写“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
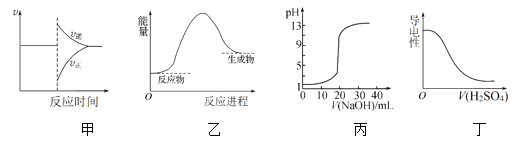
A. 图甲表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C. 图丙表示0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D. 图丁表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示:
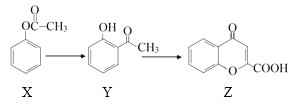
下列有关叙述正确的是
A. X分子中所有原子处于同一平面
B. X、Y、Z均能和NaOH溶液反应
C. 可用NaHCO3溶液鉴别Y和Z
D. 1 mol Y跟足量H2反应,最多消耗3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则B极的电极反应为____________________。
(2)若开始时开关K与b连接,则B极的电极反应为____________________,总反应的离子方程式为____________________。
(3)有关上述实验,下列说法正确的是______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
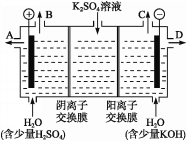
①该电解槽的阳极反应为______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白钠镁矾(mNa2SO4·nMgSO4·xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3·3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶体。
(1)热解反应的方程式为________________。
(2)碱式碳酸镁可用作化学冷却剂,原因是________________。
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器真空时,称量其质量为60.4g,此容器充满N2时总质量为66.0g,在相同状况下,充满另一气体时,总质量为70g,那么该气体可能是( )
A.Cl2B.O3C.SO2D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:

已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com