
【题目】下列有关电解质溶液的说法正确的是( )
A.Na2SO3溶液加水稀释后,pH和KW均减小
B.0.1molL﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.浓度分别为0.2molL﹣1和0.1molL﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D.室温下,PH=12的氨水与pH=2的H2SO4溶液等体积混合后,溶液呈酸性
【答案】B
【解析】A、由于KW只受温度的影响,故加水稀释时,溶液的pH变小,但Kw不变,故A不符合题意;
B、Na2CO3溶液中所有H+和OH﹣均全部来自于水,故根据质子守恒可有:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3),故B符合题意;
C、在相同温度下,将0.2mol/L的CH3COOH溶液加水稀释至原体积的2倍,则浓度变为原来浓度的 ![]() ,所以稀释后浓度为0.1mol/L,因稀释过程中醋酸电离平衡正向移动,因此0.1mol/L溶液中c(H+)大于原溶液中c(H+)的
,所以稀释后浓度为0.1mol/L,因稀释过程中醋酸电离平衡正向移动,因此0.1mol/L溶液中c(H+)大于原溶液中c(H+)的 ![]() ,因此前者与后者的c(H+)比值小于2:1,故C不符合题意;
,因此前者与后者的c(H+)比值小于2:1,故C不符合题意;
D、NH3H2O是弱电解质,不能完全电离,故将PH=12的氨水与PH=2的H2SO4溶液等体积混合后,氨水过量,故所得的溶液为硫酸铵和过量的氨水的混合溶液,溶液显碱性,故D不符合题意.故选BA.水的离子积常数只是温度的函数;
B.根据质子守恒进行判断;
C.弱电解质的浓度越大越难电离;
D.混合后氨水有剩余,氨水和硫酸铵的混合溶液呈碱性.


科目:高中化学 来源: 题型:
【题目】(Ⅰ)气体制备时须先检查装置的气密性,下列各图所示装置,肯定不符合气密性检查要求的是 .
(Ⅱ)下面是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.分液漏斗 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填编号).
(2)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g.
(3)使用前要检查仪器是否漏液的是 (填编号).
(Ⅲ)实验室需要95mL 1.0molL﹣1稀硫酸,现用98%的浓硫酸(其密度为1.84g/mL)来进行配制.若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.250mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为 mL.
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
A.将稀释的硫酸液转移至容量瓶后,未洗涤烧杯和玻璃棒.
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外.
C.未冷却至室温就定容.
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切.
E.容量瓶使用时未干燥
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是。完成酸浸过程中反应的离子方程式:
FeS2 + MnO2 + = Mn2+ + Fe2+ + S + SO42-+
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:。(结合离子方程式解释)
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是极(填“a”或“b”),生成EMD的电极反应式是。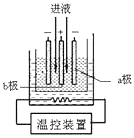
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA﹕AB=2﹕3, OA=AB, OA﹕AB=3﹕2,则下列分析与判断不正确的是(忽略CO2的溶解)( )

A. M中只有一种溶质的有(1)和(3)
B. M中有两种溶质的有(2)和(4)
C. (2)图显示M中的溶质为NaHCO3和Na2CO3,二者的物质的量之比为2:1
D. (4)图显示M中的溶质为NaOH和Na2CO3,二者的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加“碘”食盐较多使用的碘酸钾(KIO3),在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O ![]() KIO3+3H2↑.下列有关说法不正确的是( )
KIO3+3H2↑.下列有关说法不正确的是( )
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I﹣﹣6e﹣+3H2O═IO ![]() +6H+
+6H+
C.溶液调节至强酸性,对生产不利
D.电解后阴极周围溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
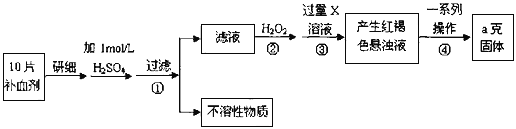
请回答下列问题:
(1)步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有__________________(填离子符号),检验滤液中还存在Fe2+的方法为_________________________________________。(注明试剂、现象)
(2)步骤②加入过量H2O2的目的:____________________________________________。
(3)步骤③中反应的离子方程式:_____________________________________________。
(4)若实验无损耗,则每片补血剂含铁元素的质量__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途.
(1)工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得: 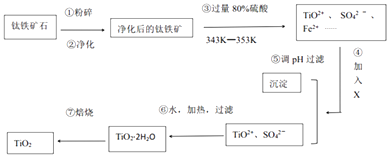
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com