
【题目】已知在温度低于570℃ 时,还原铁粉与水蒸气反应的产物是FeO;高于570℃ 时,生成Fe3O4。老师用下图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。

甲同学为探究实验后试管内固体的成分,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
试回答下列问题:
(1)湿棉花的作用是______________。
(2)写出高于570℃ 时,Fe 与水蒸气反应的化学方程式:___________。
(3)乙同学认为加入KSCN 溶液没有出现血红色的原因可能是固体中没有Fe3O4,也有可能是因为___(填物质名称)过量造成的。该物质过量时,溶液中还会发生反应,导致加入KSCN 溶液时没有出现血红色,该反应的离子方程式是______________。
(4)丙同学利用上述实验①加盐酸后的溶液制取白色的Fe(OH)2沉淀,向滤液中加入足量NaOH 溶液后,观察到的实验现象为___。
【答案】提供反应所需的水蒸气 3Fe+4H2O(g)![]() Fe3O4+4H2 铁粉 Fe+2Fe3+=3Fe2+ 先生成白色沉淀,后沉淀迅速变成灰绿色,最终变成红褐色
Fe3O4+4H2 铁粉 Fe+2Fe3+=3Fe2+ 先生成白色沉淀,后沉淀迅速变成灰绿色,最终变成红褐色
【解析】
(1)湿棉花在加热时能够提供水蒸气;
(2)铁与水蒸气在高温条件下可以发生反应生成四氧化三铁和氢气,据此来写方程式;
(3)如铁粉过量,则不能生成Fe3+;过量铁粉会与三价铁反应,生成二价铁;
(4)根据二价铁加入过量氢氧化钠溶液的现象来解答。
(1)湿棉花在加热时水蒸发形成水蒸气;
(2)铁与水蒸气在高温条件下可以发生反应生成四氧化三铁和氢气反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)过量铁粉会与三价铁反应,生成二价铁,方程式为Fe+2Fe3+=3Fe2+;
(4) 有少量气泡产生,说明铁过量,实验①加盐酸后的溶液呈浅绿色,说明含有二价铁,加入过量的氢氧化钠生成氢氧化亚铁,氢氧化亚铁不稳定易被氧化为氢氧化铁,现象为,先生成白色沉淀,后沉淀迅速变成灰绿色,最终变成红褐色。


科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是
A. 用如图电子天平称量固体,读数时侧门应关闭

B. 用托盘天平称取10.2 g NaOH固体时,将10g的砝码放在右盘,将游码移到0.2g的位置
C. 分光光度计可用于分析溶液颜色与反应物(生成物)浓度的关系,从而确定化学反应速率
D. 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:____________________
(2)配平该方程式____FeC2O4·H2O+___H2O+ __K2 C2O4+__H 2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式______;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:![]() 。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )

A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 molL-1
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C.c点所得溶液中:c(Na+)<3c(HSO3 )
D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
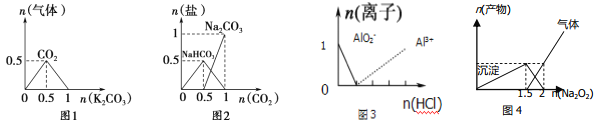
A.图1:n(HCl)=l mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(NaAlO2)=1 mol,HCl加入到NaAlO2溶液中离子的存在情况
D.图4:n(AlCl3)=1 mol,Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛的合金及其化合物用途非常广泛,回答下列问题:
(1)Al65Cu20Co15是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___方法区分晶体、准晶体和非晶体。
(2)基态Al原子价电子排布式为____,铝的第一电离能比镁的低,是因为____。
(3)AlF3的熔点(1040℃)比AlCl3(194℃)高得多,这是因为____;气态时,氯化铝以双聚体的形式存在,画出Al2Cl6的结构:____。
(4)TiO2+检验反应为TiO2++H2O2=[TiO(H2O2)]2+(橙红色),配离子[TiO(H2O2)]2+中与中心原子形成配位键的原子是__;H2O2中氧原子的杂化方式是___,H2O2的沸点(158℃)比键合方式相同的S2Cl2(138℃)的高,其原因是____。
(5)铝钛合金可用作磁控溅射镀膜的原材料,它的晶体结构及晶胞参数如图所示(Ti、Al位于面心或顶点)。阿伏加德罗常数的值为NA,则该铝钛合金的密度为__g·cm-3(列出表达式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com