
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数也可以是小数 | |
| C. | 1molH2SO4和1mo Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1molH2和0.5mol O2反应放出的热就是H2的燃烧热 |
分析 A、放热反应的焓变小于0,吸热反应的焓变大于0;
B、热化学方程式中的化学计量数只表示物质的量,不表示分子数;
C、根据中和热的概念分析判断;
D、依据燃烧热的概念进行分析判断.
解答 解:A、△H>0表示吸热反应,△H<0表示放热反应,故A错误;
B、热化学方程式中的化学计量数只表示物质的量,不表示分子数,所以可用分数或小数表示,故B正确;
C、1molH2SO4与1molBa(OH)2反应生成两mol水,根据中和热概念是强酸和强碱反应生成1mol水时放出的热量,故C错误;
D、燃烧热是指1mol可燃物完全燃烧生成稳定氧氧化物时放出的热量,1molH2与0.5molO2反应生成的水的状态不定,所以放出的热量不一定是燃烧热,故D错误;
故选B.
点评 本题考查了焓变的计算、热化学方程式的书写、中和热、燃烧热的概念应用和计算,注重基础知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
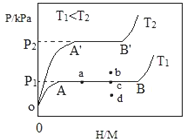 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(HCO3)2溶液加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向NH4HCO3溶液中滴入少量NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | FeSO4溶液在空气中变黄色:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 用NaOH溶液吸收NO2气体:3NO2+2NaOH═2NaNO3+NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-13mol/L的溶液中:NO3-、S2O32-、K+、Na+ | |
| B. | 酸性高锰酸钾溶液中:Na+、C2O42-、CH3COO -、NH4+ | |
| C. | 澄清石灰水中:HCO3-、Ba2+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
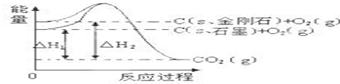
| A. | 1mol石墨的总键能比1mol金刚石的总键能小1.9kJ | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com