
| A���ۢܢ� | B���٢ڢݡ� | C���ۢܢݢޡ� | D���ڢۢ� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 ��������Ӧ��Ӧ�Ļ�ѧ����ʽ��
��������Ӧ��Ӧ�Ļ�ѧ����ʽ�� CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�| ���� | H2 | CO | CH3OH |
| Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z(g)����60 s�ﵽƽ�⣬����0.3 mol Z������˵����ȷ����( )
Z(g)����60 s�ﵽƽ�⣬����0.3 mol Z������˵����ȷ����( )| A���������¶ȣ�X�������������������ӦΪ���ȷ� |
| B�������������Ϊ20 L��Z��ƽ��Ũ�ȱ�Ϊԭ����1/2 |
| C��������ѹǿ��������Y��ת���ʼ�С |
| D����XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001 mol/(L��s) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z�� ��Ӧ�������еķ�Ӧ����(v)��ʱ��(t)�Ĺ�ϵ���ߣ�����������ȷ���� �� ��
2Z�� ��Ӧ�������еķ�Ӧ����(v)��ʱ��(t)�Ĺ�ϵ���ߣ�����������ȷ���� �� ��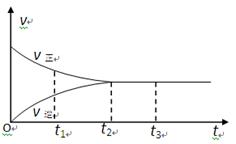
| A��t1ʱ��ֻ������Ӧ | B��t2ʱ��Ӧ�ﵽ�� |
| C��t2��t3ʱ����Ӧֹͣ | D��t2��t3ʱ��v(Y2)��v(Z) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(��) ������ӦΪ���ȷ�Ӧ���ﵽƽ���������ͼ���жϣ�
C(��) ������ӦΪ���ȷ�Ӧ���ﵽƽ���������ͼ���жϣ�
| A�� | B�� | C�� | D��E�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g)��3H2(g) ��H��0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ����
CO(g)��3H2(g) ��H��0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ����
| A��0~5 min�ڣ�v(H2)��0.1 mol��(L��min)-1 |
| B����Ӧ���е�12minʱ��CH4��ת����Ϊ25% |
| C�������£���С���������ƽ���H2Ũ�ȼ�С |
| D��10 minʱ���ı��������������������¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ����O��8 mol B�������C��Ũ��ΪO��4 mol��L������д���пհף�
xC(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ����O��8 mol B�������C��Ũ��ΪO��4 mol��L������д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g)��H2(g) ��H <0,200��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1/2.25,���¶��£���һ������CO��H2Ͷ��ij10L�ܱ�������5minʱ��ƽ�⣬������Ũ��(mol?L��1)�仯���£�
CO2(g)��H2(g) ��H <0,200��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1/2.25,���¶��£���һ������CO��H2Ͷ��ij10L�ܱ�������5minʱ��ƽ�⣬������Ũ��(mol?L��1)�仯���£�| | 0min | 5min | 10min |
| CO | 0.01 | | 0.0056 |
| H2O | 0.01 | | 0.0156 |
| CO2 | 0 | | 0.0044 |
| H2 | 0 | | 0.0044 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com