
A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
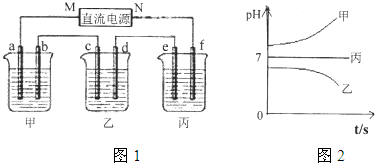
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题:
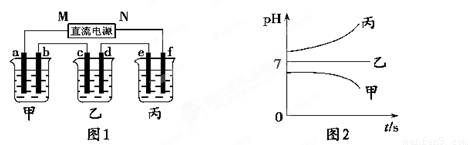
(1)写出三种强电解质的化学式:A ;B ;C 。
(2)写出乙烧杯c电极发生的电极反应为__________________________,甲烧杯中的总反应的化学方程式为___________________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为________________,甲烧杯中溶液的pH= 。(假设溶液体积是400ml)
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_____________,其质量为 。
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为________________________________
____________________,M级附近溶液的pH (选填“升高”或“降低”或“不变”)。
铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有 mol。
(1)AgNO3(1分) KNO3 (1分) KOH(1分)
(2)4OH--4e—=O2↑+2H2O(1分) 2H2O+4 AgNO3 4
Ag+ O2↑+4HNO3(1分)
4
Ag+ O2↑+4HNO3(1分)
(3)2.24L(1分) 0 (2分) (4)Ag2O (1分) 46.4g(2分)
(5)Pb-2 e—+SO42—= PbSO4(1分) 升高 (1分) 0.2(2分)
【解析】(1)甲中b电极质量增加了43.2g,所以甲中是硝酸银。由于乙中溶液的pH不变,所以乙中应该是硝酸钾。丙中溶液的pH增大,说明是氢氧化钾。
(2)b电极质量增加,所以b电极是阴极,则a是阳极,M是正极,N是负极,f、e、d、c分别是阴极、阳极、阴极、阳极。所以乙烧杯c电极发生的电极反应为4OH--4e—=O2↑+2H2O。甲烧杯中出生成银外,还生成氧气,所以的总反应的化学方程式为2H2O+4 AgNO3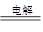 4 Ag+ O2↑+4HNO3。
4 Ag+ O2↑+4HNO3。
(3)反应中转移电子是43.2g÷108g/mol×1=0.4mol。丙烧杯e电极的方程式为4OH--4e—=O2↑+2H2O,所以生成氧气是0.1mol,标准状况下的体积是2.24L。根据甲中的总反应式可知,生成硝酸是0.4mol,其浓度是0.4mol÷0.4L=1.0mol/L,所以pH=0。
(4)甲烧杯中减少的是银和氧气,所以需要加入0.2molAg2O才能使溶液恢复到电解前的状态,质量是0.2mol×232g/mol=46.4g。
(5)N是负极,失去电子,发生氧化反应,所以方程式为Pb-2 e—+SO42—= PbSO4。M极是正极,得到电子,方程式为PbO2+2 e—+4H++SO42—= PbSO4+2H2O,所以氢离子的浓度降低,pH升高。根据充电时的阴极反应式PbSO4+2 e—=Pb+SO42—可知,当转移0.2mol电子时,生成SO42—是0.1mol,所以需要氢离子是0.2mol。


科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ | ||
| 阴离子 | SO
|

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com