
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
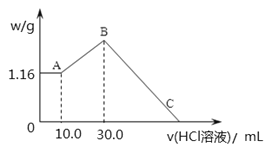
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
【答案】(1)Mg(OH)2
(2)AlO2-+H++H2O= Al(OH)3↓
(3)5.20;130
【解析】
试题分析:
①向水中有沉淀物组成的混合溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液
中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2。
故答案:Mg(OH)2;
②A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,
故答案:H2O+AlO2-+H+=Al(OH)3↓;
③A点沉淀的是氢氧化镁,则n[Mg(OH)2]=![]() =0.02mol,根据Mg原子守恒得n(MgCl2)=
=0.02mol,根据Mg原子守恒得n(MgCl2)=
n[Mg(OH)2]=0.02mol;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+
AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol;根据铝
原子守恒得n(AlCl3)= n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)
=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,氢氧化钠的质
量m(NaOH)==0.13mol×40g/mol=5.2g;C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸用
于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)= n(NaOH)=0.13mol;C点所表示盐酸
的体积为:V=![]() =0.13L=130ml。
=0.13L=130ml。
故答案为:5.2;130。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是()。

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后.向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280mL(标准伏况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的只有( )
A. 碱性:KOH>NaOH
B. 相对原子质量:Ar>K
C. 酸性:HClO4>H2SO4
D. 元素的金属性:Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠大量用于染料和有机合成工业。用木屑制备亚硝酸钠的流程如下:
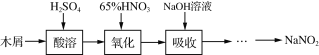
已知氧化过程中,控制反应液的温度在55~60℃条件下发生的主要反应为:
C6H12O6+12HNO3==3H2C2O4+9NO2↑+3NO↑+9H2O
(1)酸溶过程中,硫酸的作用是 。吸收完成后,将吸收液蒸发浓缩、冷却结晶、过滤、洗涤得到白色晶状的亚硝酸钠。
(2)实验室模拟氧化和吸收过程的装置如右图所示,A装置须控制反应液的温度不高于60℃的原因是 ;B装置用于制备亚硝酸钠,其中盛放的溶液是 (填字母)。
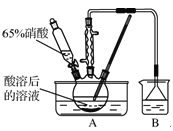
a.NaCl溶液 b.Na2CO3溶液 c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1∶1。若(NO)∶n(NO2)>1∶1,则会导致 ;若n(NO)∶n(NO2)<1∶1会使产品中混有的杂质为 。
(4)已知NaNO2能把酸性条件下的Fe2+氧化,同时产生一种有毒的气体,请写出该反应的离子方程式: 。
(5)已知:①NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O又能把I2还原为I-。②NaNO2也有还原性,能使酸性KMnO4溶液褪色。为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解, 。
实验中可供选择的试剂:
稀硫酸、c1 mol·L-1 KI溶液、淀粉溶液、c2 mol·L-1 Na2S2O3溶液、c3 mol·L-1酸性KMnO4溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期主族元素的性质或原子结构如下表:

(1)元素Y在周期表中的位置_________ (周期、族)。
(2)XN2的电子式是:_________,Y的简单氢化物的结构式_________。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________。
(4)用电子式表示WZ的形成过程_________。
(5)元素Z和T相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________。
A.常温下Z单质和T单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式_________ ,所得溶液的溶质是_________化合物(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验装置中, A、E分别为NH3和Cl2的发生装置。
请回答下列问题:
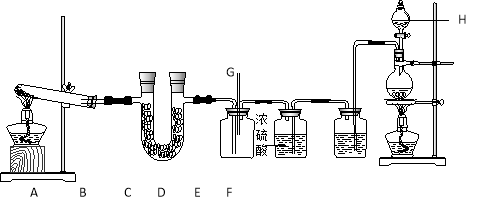
(1)装置E中发生反应的离子方程式为 。
(2)甲、乙两同学分别采用下列两种方案制取C12:甲:用含HCl 146g的浓盐酸与足量的MnO2反应。乙:用87g MnO2与足量浓盐酸反应。则所得氯气__________(填字母)。
a.甲比乙多 b.乙比甲多 c.一样多
(3)仪器H的名称是_____________(填名称) ,装置D的作用是 。
(4)装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用 进行尾气处理(填选用试剂的名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为 ,它与水反应的离子方程式是 。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂_________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2 并测定其含量。取20.00 mL溶液,用稀H2SO4酸化,用0.002mol·L-1 KMnO4溶液滴定,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目: 2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O。
③溶液a中c(H2O2)=_________mol·L-1。
④溶液褪色速率后阶段变快的原因可能是____ _ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(有机化学基础)分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
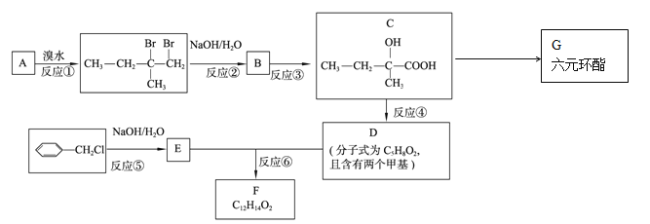 试回答下列问题:
试回答下列问题:
(1)A物质名称为(系统命名) 。
(2)合成路线中反应③所属反应类型为 。
(3)有机物G的结构简式为 。
(4)有机物D中所含官能团的名称为 。
(5)关于有机物C,下列说法正确的是( )
A.等物质的量的C分别与足量的金属钠和NaHCO3反应,后者产生气体多
B.一定条件下,有机物C能通过缩聚反应形成高分子化合物
C.1molC完全燃烧生成CO2和H2O,消耗的氧气的物质的量为6mol
D.有机物C中的所有碳原子可能在同一平面上
(6)反应⑥的化学反应方程式为 。
(7)F有多种同分异构体,请写出符合下列条件的所有同分异构体的结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3; 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com