
【题目】下列事实不能用元素周期律解释的只有( )
A. 碱性:KOH>NaOH
B. 相对原子质量:Ar>K
C. 酸性:HClO4>H2SO4
D. 元素的金属性:Mg>Al
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】目前半导体生产展开了一场“铜芯片”革命—在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:


(1)基态铜原子的外围电子排布式为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是___,其立体结构是____。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深
沉淀溶解,得到深
蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式______;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。((用含d和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是

A.该过程中,能量的转化形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水反应的化学方程式为2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D.总反应式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分析如图所示的三个装置,回答下列问题:

①装置a中铝电极上的电极反应式为________________________。
②装置b中产生气泡的电极为________电极(填“铁”或“铜”),装置c中铜电极上的电极反应式为_____________________________________。
燃料电池是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲烷、肼等。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为:__________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
(3)肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的负极电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3= + 44.0kJ·mol-1
H2O(g)ΔH3= + 44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的逆反应平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.增大CO2和H2的初始投料比 E.投料比不变,增加反应物的浓度
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T3℃时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液。这三种物质的溶解度随温度而变化的曲线如右图。从T3降至T1,下列有关说法正确的是
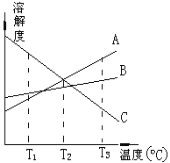
A.T3℃时,由A物质所形成的溶液的物质的量浓度最大
B.T2℃时,由A、C两物质形成的溶液质量分数相等
C.T1℃时,由B物质所形成的溶液质量分数最大,C的最小
D.从溶解度曲线可知分离A、C的混合溶液得到A可采用蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
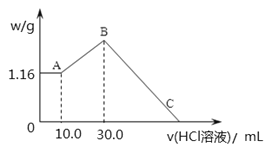
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com