
【题目】将Cu放入0.1 molL﹣1FeCl3溶液中,反应一段时间后取出Cu片,溶液中Fe3+与Fe2+的物质的量浓度之比为4:3,则反应后溶液中Cu2+与Fe3+的物质的量之比为
A.3:2 B.3:8 C.4:3 D.3:4
科目:高中化学 来源: 题型:
【题目】有机物A只由C、H、O三种元素组成.常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0gCO2和7.2g水。质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-O-H和位于分子端的-C-H,该核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1
(1)写出A的分子式_______;(2)写出A的结构简式________;
(3)下列物质一定能与A发生反应的是______(填序号)
a.氢溴酸 b.高锰酸钾 c.溴的四氯化碳 d. Na
(4)有机物B是A的同分异构体,1molB可以与1molBr2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示3种峰,且峰面积之比为6:1:1。则B的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量变大
C. 升高温度,反应速率加快,反应放出的热量不变
D. 增加反应物的浓度,反应速率加快,原因是单位体积内增加了活化分子的数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂的废气SO2,并制备
MnSO4·H2O晶体,其工艺流程如下:

已知:①浸出液的pH<2,其中的金属阳离子主要是Mn2+,还有少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 |
请回答下列问题:
(1)加入MnO2氧化时溶液中反应的离子方程式为_______________________________。
(2) 若流程中取消“加入MnO2”,对上述流程的影响是____________________________。
(3)试剂X能否选用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2],判断并说明理由: ________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是___________________。
(5)从滤液中提取MnSO4·H2O晶体的操作是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的有机物在酸性条件下可水解为酸和醇,且生成的醇没有相同官能团的同分异构体。若不考虑立体异构,该酯的同分异构体共 种
A. 6种B. 8种
C. 12种D. 16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+、MnO4-、Na+、Cl- B.Na+、H+、NO3-、SO42-
C.Fe3+、Na+、Cl-、SO42- D.K+、Na+、NO3-、CO32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)常用于脱硫的催化剂。工业上利用软锰矿(主要成分是MnO2,还含有钙、铁、铝镁的氧化物及一些重金属的氧化物)制备无水碳酸锰的工艺流程如下:
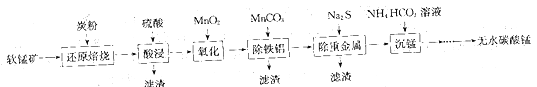
回答下列问题:
(1)为了提高“酸浸”步骤中原料的浸出率,可以采取的措施有___________(填字母)。
a.适当升温 b.连续搅拌 c.研磨矿石 d.加入足量的水
(2)“氧化”步骤中利用MnO2将溶液中Fe2+氧化为Fe3+,反应的离子方程式为_____________。
(3)“除铝铁”步骤中用MnCO3调节溶液pH的优点是___________________(写出一点),也可以用(填化学式)_____________代替MnCO3。
(4)“沉锰”步骤中反应温度需要控制在30~35℃以下,反应温度控制在35℃以下的原因是____,写出“沉锰”步骤中发生反应的化学方程式:________________________。
(5)25℃时,Ksp(MnCO3)=2.2×10-11,Ksp(MgCO3)=6.8×10-6。“沉锰”步骤中当Mn2+刚好沉淀完全[c(Mn2+)=1×10-5mol·L-1]时,若不析出MgCO3沉淀,则此时c(Mg2+)不能超过_____________mol·L-1(计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积一定是22.4L
C.在标准状况下,NA个任何分子所占的体积约为22.4L
D.在标准状况下,28g的N2体积约为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com