
【题目】碳酸锰(MnCO3)常用于脱硫的催化剂。工业上利用软锰矿(主要成分是MnO2,还含有钙、铁、铝镁的氧化物及一些重金属的氧化物)制备无水碳酸锰的工艺流程如下:
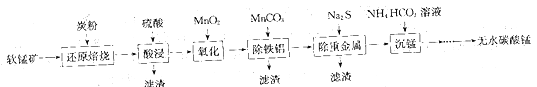
回答下列问题:
(1)为了提高“酸浸”步骤中原料的浸出率,可以采取的措施有___________(填字母)。
a.适当升温 b.连续搅拌 c.研磨矿石 d.加入足量的水
(2)“氧化”步骤中利用MnO2将溶液中Fe2+氧化为Fe3+,反应的离子方程式为_____________。
(3)“除铝铁”步骤中用MnCO3调节溶液pH的优点是___________________(写出一点),也可以用(填化学式)_____________代替MnCO3。
(4)“沉锰”步骤中反应温度需要控制在30~35℃以下,反应温度控制在35℃以下的原因是____,写出“沉锰”步骤中发生反应的化学方程式:________________________。
(5)25℃时,Ksp(MnCO3)=2.2×10-11,Ksp(MgCO3)=6.8×10-6。“沉锰”步骤中当Mn2+刚好沉淀完全[c(Mn2+)=1×10-5mol·L-1]时,若不析出MgCO3沉淀,则此时c(Mg2+)不能超过_____________mol·L-1(计算结果保留1位小数)。
【答案】 abc MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 不引入新的杂质(或增加碳酸锰的产量) Mn(OH)2 减少碳酸氢铵的分解,提高原料利用率 MnSO4+2NH4HCO3![]() MnCO3↓+(NH4)2SO4+CO2↑+H2O 3.1
MnCO3↓+(NH4)2SO4+CO2↑+H2O 3.1
【解析】(1)搅拌固体和液体的混合物,升高温度、搅拌和增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有适当升温、连续搅拌、研磨矿石等,加水是稀释,速率降低,故答案为abc;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)“除铝铁”步骤中用MnCO3调节溶液pH既能降低H+的浓度,又不引入新的杂质,同时还能增加碳酸锰的产量,根据除杂原则,也可以用 Mn(OH)2 代替MnCO3;
(4)“沉锰”步骤中需要滴加碳酸氢铵溶液,因碳酸氢铵不稳定,受热易分解,则反应温度控制在35℃以下,以减少碳酸氢铵的分解,提高原料利用率;本操作步骤中可获得MnCO3沉淀,同时生成(NH4)2SO4和CO2,根据原子守恒可得此反应的化学方程式为MnSO4+2NH4HCO3![]() MnCO3↓+(NH4)2SO4+CO2↑+H2O ;
MnCO3↓+(NH4)2SO4+CO2↑+H2O ;
(5)已知Ksp(MnCO3)=c(Mn2+)×c(CO32-)=2.2×10-11,当c(Mn2+)=1×10-5mol·L-1时,c(CO32-)=2.2×10-6mol·L-1,则Ksp(MgCO3)=c(Ca2+)×c(CO32-)=6.8×10-6,c(Ca2+)=3.1mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述中正确的是( )
A. 钠与氧气反应时,产物是由O2的用量决定的
B. 打磨的铝箔加热至熔化时,铝会滴落
C. 点燃镁之前,应先用砂纸打磨
D. 铁只能与氧气反应,与氯气不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu放入0.1 molL﹣1FeCl3溶液中,反应一段时间后取出Cu片,溶液中Fe3+与Fe2+的物质的量浓度之比为4:3,则反应后溶液中Cu2+与Fe3+的物质的量之比为
A.3:2 B.3:8 C.4:3 D.3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属表面氧化技术可提高金属的抗腐蚀性能,利用如图电解装置,通过控制电流强度,可在铝片表面形成一层不溶于稀硫酸的坚固Al2O3薄膜。下列叙述中正确的是( )

A. 关闭K后,在电极b上有金属铝生成
B. 电极a为石墨电极,电极b为铝电极
C. 关闭K后,电极a上有氧气生成
D. 阳极电极反应式为 2A1-6e-+3H2O=A12O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用的说法中,均正确的是
A.石英能导电,所以用作光导纤维
B.明矾与水反应生成氢氧化铝胶体,可用于自来水消毒
C.氧化铝熔点高,常用于耐高温材料
D.苏打溶液呈弱碱性,可用作胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种酸性氧化物,溶于水生成亚硫酸。某同学对SO2的氧化性和亚硫酸的酸性进行了探究。回答下列问題:
(一)SO2的制备
该同学制备SO2的实验装置如下:

(1)装置A中发生反应的化学方程式为__________________________________________。
(2)装置C中盛有的是NaOH溶液,其作用是_________________________。
(二)验证SO2氧化性
待装置B中收集满SO2后,夹紧止水夹K1和K2取下装置 B,利用收集到的SO2验证其氧化性。
(3)设计一种验证SO2具有氧化性的方法:__________________________________________(要体现所使用检验试剂的名称和实验现象等要点)。
(4)将溶液R(足量)加人装置B的储气瓶中可将SO2排出进入检验试剂中,则溶液R是________。
(三)探究H2SO3的酸性强于HClO
由于次氯酸盐具有较强的氧化性,故不能直接将SO2通入次氯酸盐中检验H2SO3的酸性强于HClO,该同学用装置B中收集到的SO2,利用下面装置间接地完成了验证。

(5)装置的连接顺序为B→______________,F的作用是______________________________。
(6)可证明H2SO3的酸性强于HClO的实验现象是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
酯中的OR′被一个醇(或酚)的OR″置换的反应称为酯交换反应(ester exchange)。
RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
该反应在生物柴油、高分子材料合成等方面具有重要价值。下面是以乙烯为原料,利用酯交换反应合成高分子材料PC和PET的一种合成路线(部分产物及反应条件已略去):
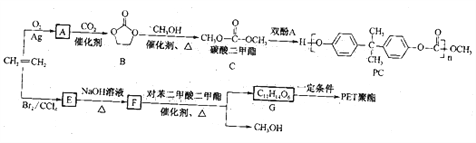
回答下列问题:
(1)A是一种三元环状化合物,且由乙烯生成A时反应的原子利用率为100%,则A的结构简式为_____________。
(2)“双酚A”的结构简式为__________,高分子材料PC中所含官能团的名称是__________。
(3)由B→C的反应类型是_____________,由G→PET聚酯的反应类型是_____________。
(4)由E→F得化学方程式为_______________________________________________。
(5)满足如下条件的对苯二甲酸二甲酯的同分异构体共有_____________种,其中核磁共振氢谱有4组峰,且峰面积之比为1∶1∶1∶2的同分异构体的名称为_____________。
①苯环上的一氯代物只有两种
②苯环上的取代基不超过三个
③0.1mol该有机物与足量的碳酸氢钠溶液反应,能产生4.48L(标准状况下)CO2
(6)参照![]() 的合成方法,设计一条由2-溴丙烷和必要的无机试剂制备
的合成方法,设计一条由2-溴丙烷和必要的无机试剂制备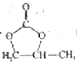 的合成路线:_________________________。
的合成路线:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用化学用语回答:
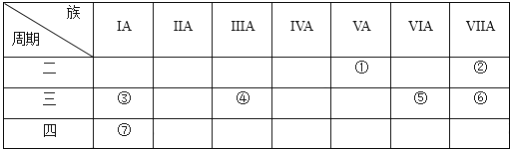
(1)②的元素符号为_________。
(2)比较元素③和⑦的原子半径大小:③_____⑦(填“>”或“<”)。
(3)绘出元素⑤的离子结构示意图_________________。
(4)元素①的氢化物的电子式为____________,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的根本区别是
A. 是否有丁达尔现象 B. 分散质粒子的大小
C. 能不能通过滤纸或半透膜 D. 是否均一、稳定、透明
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com