
【题目】下列关于金属性质的叙述中正确的是( )
A. 钠与氧气反应时,产物是由O2的用量决定的
B. 打磨的铝箔加热至熔化时,铝会滴落
C. 点燃镁之前,应先用砂纸打磨
D. 铁只能与氧气反应,与氯气不反应
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】热水瓶用久后,瓶胆内常附着一层水垢[主要成分为CaCO3与Mg(OH)2]。能用来清除水垢的是
A. 食醋 B. 白酒 C. 纯碱 D. 食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只由C、H、O三种元素组成.常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0gCO2和7.2g水。质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-O-H和位于分子端的-C-H,该核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1
(1)写出A的分子式_______;(2)写出A的结构简式________;
(3)下列物质一定能与A发生反应的是______(填序号)
a.氢溴酸 b.高锰酸钾 c.溴的四氯化碳 d. Na
(4)有机物B是A的同分异构体,1molB可以与1molBr2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示3种峰,且峰面积之比为6:1:1。则B的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E、F、G的原子序数依次增大,A、F原子的最外层电子数等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同的能级,且每个能级上排布的电子数相等;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F;G原子最外层有一个单电子,且内层原子轨道均排满。
(1)与C单质分子互为等电子体的分子为________,该分子的电子式为______________。
(2)B、C、D、E、F五种元素第一电离能从大到小的顺序:____________(填元素符号)
(3)光谱证实:单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在_________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
(4)B、C、D三种元素与A形成的最简单化合物的稳定性由强到弱的顺序:______(填化学式)
(5)G位于元素周期表的____区,向含有G2+离子的溶液中通入A、C形成的最简单分子至过量,观察到的现象是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,HA的电离平衡常数Ka=6.25×10-5,H2CO3的电离平衡常数Ka1=4.17×10-7、Ka2=4. 90×10 -11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法不正确的是(不考虑饮料中其他成分)
A. 相同物质的量浓度的NaA、HA混合溶液呈碱性
B. 提高CO2兖气压力,碳酸饮料中c (A-)减小
C. 当碳酸饮料的pH为5.0时,![]()
D. 碳酸饮料中各粒子的浓度关系为c( H+) =c( HCO3-)+2c( CO32-) +c(OH-) -c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列有机物:
A.CH3CH2CHO和![]() B.
B.  和
和![]()
C.![]() 与
与![]() D.CH3CH=CH2和CH3CH2CH2Br
D.CH3CH=CH2和CH3CH2CH2Br
(1)上述各组化合物中,属于同系物的是________(填字母,下同),属于同分异构体的是________。
(2)C组中两种化合物的官能团的名称为________;区别B组中两种化合物的试剂为________。
(3)写出D组中CH3CH2CH2Br转化为CH3CH=CH2的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量变大
C. 升高温度,反应速率加快,反应放出的热量不变
D. 增加反应物的浓度,反应速率加快,原因是单位体积内增加了活化分子的数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)常用于脱硫的催化剂。工业上利用软锰矿(主要成分是MnO2,还含有钙、铁、铝镁的氧化物及一些重金属的氧化物)制备无水碳酸锰的工艺流程如下:
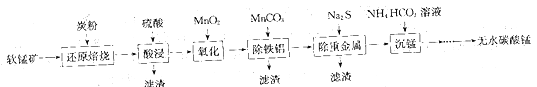
回答下列问题:
(1)为了提高“酸浸”步骤中原料的浸出率,可以采取的措施有___________(填字母)。
a.适当升温 b.连续搅拌 c.研磨矿石 d.加入足量的水
(2)“氧化”步骤中利用MnO2将溶液中Fe2+氧化为Fe3+,反应的离子方程式为_____________。
(3)“除铝铁”步骤中用MnCO3调节溶液pH的优点是___________________(写出一点),也可以用(填化学式)_____________代替MnCO3。
(4)“沉锰”步骤中反应温度需要控制在30~35℃以下,反应温度控制在35℃以下的原因是____,写出“沉锰”步骤中发生反应的化学方程式:________________________。
(5)25℃时,Ksp(MnCO3)=2.2×10-11,Ksp(MgCO3)=6.8×10-6。“沉锰”步骤中当Mn2+刚好沉淀完全[c(Mn2+)=1×10-5mol·L-1]时,若不析出MgCO3沉淀,则此时c(Mg2+)不能超过_____________mol·L-1(计算结果保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com