
【题目】热水瓶用久后,瓶胆内常附着一层水垢[主要成分为CaCO3与Mg(OH)2]。能用来清除水垢的是
A. 食醋 B. 白酒 C. 纯碱 D. 食盐水
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是
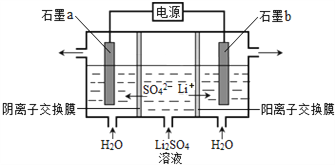
A. b极附近溶液的pH增大
B. a极发生的反应为:2H2O – 4e—= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1 mol电子时,可得到2 molLiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是

A. O2-向正极移动
B. 负极的电极反应式为:NO-2e-+O2-=NO2
C. O2的电极反应产物是H2O
D. 反应消耗的NO与O2的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
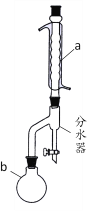
【题目】乙酸丁酯是优良的有机溶剂,因有愉快的果香气味,也用于香料工业。实验室制取乙酸丁酯的有关信息及装置示意图如下:
密度/(g·cm-3) | 沸点/℃ | 水溶性 | |
1-丁醇 | 0.81 | 117.7 | 可溶 |
乙 酸 | 1.05 | 117.9 | 互溶 |
乙酸丁酯 | 0.88 | 126.3 | 微溶 |
实验操作流程为:

(1)装置a的名称是_____________,其中冷却水的流动方向是____________。
(2)制取乙酸丁酯的化学方程式为___________________________________。加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶b,从平衡角度考虑,分水器的作用是________________________________________。
(3)反应结束后,把分水器中的酯层和b中的反应液一起倒入分液漏斗中。在分液漏斗中加入10mL水洗涤,除去下层,上层继续用10mL10%Na2CO3溶液洗涤至中性,分液后将上层液体再用10mL水洗涤,除去溶于酯中的少量无机盐。下列说法不正确的是____________(填序号)。
A.最初用10mL水洗涤的目的是除去酸及少量的正丁醇
B.用10mL10%Na2CO3洗涤的目的是除去残留的硫酸和乙酸
C.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
D.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
(4)在洗涤、分液后的乙酸丁酯中加入少量无水硫酸镁,其目的是________________________。
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
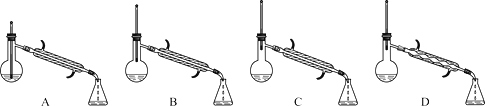
(6)本实验的产率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组欲用下列装置制备纯净的氯气及含氯化物,并探究其性质。

(1)欲制备并收集一瓶纯净的氯气,选择上图中合适的装置,其连接顺序为:__________________(按气流方向,用小写字母表示)。根据选择的装置,写出制备氯气的化学方程式_______________________。
(2)取100mL氯气与NaOH溶液反应生成的“84”消毒液,持续通入过量的SO2,溶液中开始出现黄绿色,后黄绿色逐渐褪去。溶液变为黄绿色的可能原因是:
①溶液中Cl-与ClO-反应所致,设计实验方案确认这种可能性:________________。
②_________________所致(用离子方程式表示)。
向反应后的溶液中先加入足量稀盐酸,再加入足量氯化钡溶液,经过滤、洗涤、干燥、称量,所得沉淀的质量为w g,则溶液中NaC1O的物质的量浓度为________mol·L-1。
(3)在加热条件下,氯气与NaOH溶液反应生成NaC1O3和NaC1等,写出反应的离子方程式___________________。
实验小组设计下图装置(加热装置略去)验证NaClO3的性质。

已知:2NaClO3+Na2C2O4+2H2SO4(稀)=2C1O2↑+2CO2↑+2Na2SO4+2H2O;C1O2与氯气的化学性质相似。控制装置A中分液漏斗活塞,缓慢滴加稀硫酸,观察到B装置中的现象是_____________;装置C吸收的物质是 ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为CO、CO2、N2等,其中CO含量约占25%左右。
(1)研究表明,由CO可以直接合成多种化工产品,如生产甲醇。
已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1
CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ·mol-1。则CO(g)燃烧热为__________kJ·mol-1。
(2)人体中肌红蛋白(Mb)与血红蛋白(Hb)的主要功能为运输氧气与二氧化碳。肌红蛋白(Mb)可以与小分子X(如氧气或一氧化碳)结合,反应方程式为:Mb(aq)+X(g)![]() MbX(aq)
MbX(aq)
①通常用p表示分子X的压力,p0表示标准状态大气压,若X分子的平衡浓度为p/p0,写出上述反应的平衡常数表达式:K=__________.请用p/p0及K表示吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例__________。
②在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),下图最能代表结合率(f)与此两种气体压力(p)的关系的是____________
③人体中的血红蛋白(Hb)同样能吸附O2、CO2和H+,相关反应方程式及其化学平衡常数分别是:
Ⅰ.Hb(aq)+H+(aq)![]() HbH+(aq);K1
HbH+(aq);K1
Ⅱ.HbH+(aq)+O2(g)![]() HbHO2(aq)+H+;K2
HbHO2(aq)+H+;K2
Ⅲ.Hb(aq)+O2(g)![]() HbO2(aq)K3
HbO2(aq)K3
Ⅳ.HbO2(aq)+H+(aq)+CO2(g)![]() Hb(H+)CO2(aq)+O2(g);△H4
Hb(H+)CO2(aq)+O2(g);△H4
则K3=__________(用K1、K2表示),若低温下反应Ⅳ能自发进行,则该反应△H____0,△S__0(填“>”“<”或“=”)
(3)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=cmol/L,则c(CO32-)=_____mol/L(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下:

下列说法错误的是
A. 物质X中所有碳原子可能在同一平面内
B. 可用FeCl3溶液鉴别Z中是否含有X
C. 等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为3:5
D. 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸。常温下,向10mL 0.01mol · L-1的H2N2O2溶液滴加0.01mol/L的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是

A. 由a点到n点水的电离程度依次增大
B. a点时,c (H2N2O2) > c (Na+)
C. m点时,c(OH-)+c(N2O22-)=c(H2N2O2) + c (H+)
D. m点到n点,  比值增大
比值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述中正确的是( )
A. 钠与氧气反应时,产物是由O2的用量决定的
B. 打磨的铝箔加热至熔化时,铝会滴落
C. 点燃镁之前,应先用砂纸打磨
D. 铁只能与氧气反应,与氯气不反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com