
【题目】通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是

A. O2-向正极移动
B. 负极的电极反应式为:NO-2e-+O2-=NO2
C. O2的电极反应产物是H2O
D. 反应消耗的NO与O2的物质的量之比为1:2
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应式为 4NH3+3O2═2N2+6H2O 你认为电解质溶液应显性(填“酸性”“中性““碱性”),写出正极的电极反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A>B>C>D ②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲:![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
乙:![]() 无色,无气味并且易燃。是常见的一种化石能源。
无色,无气味并且易燃。是常见的一种化石能源。
丙:![]() 有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌。请根据上述信息回答下列问题。
有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌。请根据上述信息回答下列问题。
(1)请写出BC2分子的电子式:_______________。
(2)A所在周期中,E元素的单质还原性最强,F元素的氧化物具有两性。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生反应:_______________________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生反应:_________________________________________。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入硫酸酸化的硫酸亚铁溶液。滴加过程中试管中溶液变成深棕黄色;开始有少量气泡出现(经验证是氧气),片刻后反应变得剧烈;继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀。请回答“片刻后反应变得剧烈”的原因可能是:
a________________________;b______________________。
(4)请你预测:如果发现了原子序数为116号的元素,它在周期表中的位置是_______,它属于____________元素(填“金属”或“非金属”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为11NA
C.标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA
D.0.5molC3H8分子中含C﹣H共价键2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前材料科学的发展方兴未艾。B、N、Ti、Cu、Zn都是重要的材料元素,其单质和化合物在诸多领域都有广泛的应用。
(1)单晶硅太阳能电池片加工时一般掺杂微量的铜,二价铜离子的价电子排布式为_____________。在高温条件下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释__________________。
(2)BF3分子与NH3分子的空间构型为__________、___________,BF3与NH3反应生成的BF3·NH3分子中含有的化学键类型为_________________。
(3)金属Ti的性能优越,能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C_____B(填“>”或“<”,下同),第一电离能:N_______O。
(4)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3),钛酸亚铁与浓硫酸反应生成TiSO4,SO42-中S原子的杂化方式为________,用价层电子对互斥理论解释SO32-的键角比SO42-键角小的原因__________________。
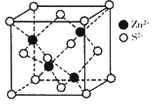
(5)ZnS在荧光体、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为a cm,密度为__________g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热水瓶用久后,瓶胆内常附着一层水垢[主要成分为CaCO3与Mg(OH)2]。能用来清除水垢的是
A. 食醋 B. 白酒 C. 纯碱 D. 食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只由C、H、O三种元素组成.常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0gCO2和7.2g水。质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-O-H和位于分子端的-C-H,该核磁共振氢谱显示有3种峰,且峰面积之比为6:1:1
(1)写出A的分子式_______;(2)写出A的结构简式________;
(3)下列物质一定能与A发生反应的是______(填序号)
a.氢溴酸 b.高锰酸钾 c.溴的四氯化碳 d. Na
(4)有机物B是A的同分异构体,1molB可以与1molBr2加成,该有机物的所有碳原子在同一平面上,核磁共振氢谱显示3种峰,且峰面积之比为6:1:1。则B的结构简式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com