
【题目】1mol某气态烃完全燃烧,生成3molCO2和2molH2O,此烃是( )
A. C3H4B. C3H6C. C3H8D. C4H10
科目:高中化学 来源: 题型:
【题目】下列叙述的方法不正确的是( )
A.金属的电化学腐蚀比化学腐蚀更普遍
B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀
D.用牺牲锌块的方法来保护船身
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是
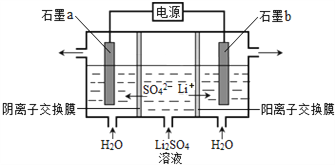
A. b极附近溶液的pH增大
B. a极发生的反应为:2H2O – 4e—= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1 mol电子时,可得到2 molLiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某种软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)为主要原料生产KMnO4的一种流程图如下:
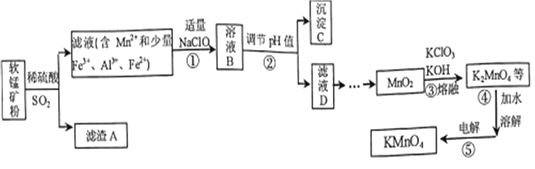
已知:Mn(OH)2极易被空气氧化;Fe(OH)3、Al(OH)3的溶度积常数依次为4.0×10-38、1.3×10-33。
(1)滤渣A的化学式是_________;溶液B中的主要阴离子有______________。
(2)为避免引入杂质,②步调节pH加入的物质是____________;调节pH除杂过程中,后析出的
沉淀是________________。
(3)浓硫酸与MnO2反应也能生成Mn2+,其化学方程式是___________________。
(4) K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,则③步原料应保证_______________。
④步溶解水应煮沸的目的是_____________________。
(5)⑤步的阳极电极反应式是____________;该法电解时要产生污染,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 mol/L的AlCl3溶液中氯离子浓度相等的是
A.150 mL 1 mol/L的NaCl B.75 mL 3 mol/L的NH4Cl
C.150 mL 2 mol/L的KCl D.75 mL 2 mol/L的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中能大量共存的离子组是( )
A. Ca2+、Na+、NO3-、CO32- B. Na+、Cl-、NH4+、SO42-
C. K+、Cl-、HCO3-、NO3- D. Ca2+、Na+、Fe3+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是

A. O2-向正极移动
B. 负极的电极反应式为:NO-2e-+O2-=NO2
C. O2的电极反应产物是H2O
D. 反应消耗的NO与O2的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯是优良的有机溶剂,因有愉快的果香气味,也用于香料工业。实验室制取乙酸丁酯的有关信息及装置示意图如下:
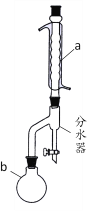
密度/(g·cm-3) | 沸点/℃ | 水溶性 | |
1-丁醇 | 0.81 | 117.7 | 可溶 |
乙 酸 | 1.05 | 117.9 | 互溶 |
乙酸丁酯 | 0.88 | 126.3 | 微溶 |
实验操作流程为:

(1)装置a的名称是_____________,其中冷却水的流动方向是____________。
(2)制取乙酸丁酯的化学方程式为___________________________________。加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶b,从平衡角度考虑,分水器的作用是________________________________________。
(3)反应结束后,把分水器中的酯层和b中的反应液一起倒入分液漏斗中。在分液漏斗中加入10mL水洗涤,除去下层,上层继续用10mL10%Na2CO3溶液洗涤至中性,分液后将上层液体再用10mL水洗涤,除去溶于酯中的少量无机盐。下列说法不正确的是____________(填序号)。
A.最初用10mL水洗涤的目的是除去酸及少量的正丁醇
B.用10mL10%Na2CO3洗涤的目的是除去残留的硫酸和乙酸
C.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
D.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
(4)在洗涤、分液后的乙酸丁酯中加入少量无水硫酸镁,其目的是________________________。
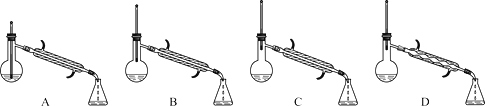
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(6)本实验的产率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸。常温下,向10mL 0.01mol · L-1的H2N2O2溶液滴加0.01mol/L的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是

A. 由a点到n点水的电离程度依次增大
B. a点时,c (H2N2O2) > c (Na+)
C. m点时,c(OH-)+c(N2O22-)=c(H2N2O2) + c (H+)
D. m点到n点,  比值增大
比值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com