
【题目】最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应式为 4NH3+3O2═2N2+6H2O 你认为电解质溶液应显性(填“酸性”“中性““碱性”),写出正极的电极反应方程式: .
科目:高中化学 来源: 题型:
【题目】将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分燃烧,最后所得的固体物质是( )
A.硅酸钠 B.碳酸钠、硅酸钠
C.碳酸钠、二氧化硅 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质所含的分子数(或原子数)等于阿伏加德罗常数的是
A. 0.5mo1 C2H4 B. 11.2L(标准状况) C2H2 气体
C. 23g Na D. 9g H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述的方法不正确的是( )
A.金属的电化学腐蚀比化学腐蚀更普遍
B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀
D.用牺牲锌块的方法来保护船身
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH) 3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用某种方法,使浆液分离成固体混合物和含铬元素溶液,并回收利用,回答有关问题。

(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为______________。C→Al的制备方法称为_____________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 。由此判断影响该反应有效进行的因素有(填序号)____________。
a、温度 b、Cl﹣的浓度 c、溶液的酸度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素。X、Z和W的原子最外层电子教之和为20。回答下列问题:
(1)X在兀素周期表中的位置是______________。
(2)X和Y元素简单离子的半径较大的是_____(填离子符号);Z和W元素气态氢化物的稳定性较强的是______(填化学式)。
(3)Y的氧化物中既含离子键又含共价键的是_____(用电子式表示)。
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①晶体中分子间作用力越大,分子越稳定 ②原子晶体中共价键越强,熔点越高 ③干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在Na2O和Na2O2晶体中,阴、阳离子数之比相等 ⑤正四面体构型的分子,键角都是109°28′,其晶体类型可能是原子晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8 g碳元素的金刚石晶体中的共价键的物质的量为0.8 mol
A. ①②③④⑤ B. ②④⑦ C. ⑤⑥⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是
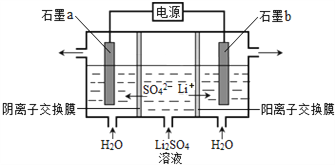
A. b极附近溶液的pH增大
B. a极发生的反应为:2H2O – 4e—= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1 mol电子时,可得到2 molLiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过NO传感器可监测汽车排放尾气中NO含量,其工作原理如图所示,下列说法正确的是

A. O2-向正极移动
B. 负极的电极反应式为:NO-2e-+O2-=NO2
C. O2的电极反应产物是H2O
D. 反应消耗的NO与O2的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com