
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素。X、Z和W的原子最外层电子教之和为20。回答下列问题:
(1)X在兀素周期表中的位置是______________。
(2)X和Y元素简单离子的半径较大的是_____(填离子符号);Z和W元素气态氢化物的稳定性较强的是______(填化学式)。
(3)Y的氧化物中既含离子键又含共价键的是_____(用电子式表示)。
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为_________。
【答案】 第二周期、第ⅦA族 F- HCl ![]() 3H2SO4(浓)+Cu2O
3H2SO4(浓)+Cu2O![]() 2CuSO4+SO2↑+3H2O
2CuSO4+SO2↑+3H2O
【解析】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,因此X是F,W是Cl。Y为同周期主族元素中原子半径最大的元素,Y是Na。X、Z和W的原子最外层电子教之和为20,则Z的最外层电子数=20-7-7=6,所以Z是S。
(1)F在元素素周期表中的位置是第二周期、第ⅦA族。(2)X和Y元素简单离子的核外电子排布相同,离子半径随原子序数增大而减小,则离子半径较大的是F-;氯元素非金属性强于S,则Z和W元素气态氢化物的稳定性较强的是HCl。(3)Y的氧化物中既含离子键又含共价键的是过氧化钠,电子式为![]() 。(4)Z的最高价氧化物对应水化物的浓溶液(过量)是硫酸,具有强氧化性,和氧化亚铜共热反应的化学方程式为
。(4)Z的最高价氧化物对应水化物的浓溶液(过量)是硫酸,具有强氧化性,和氧化亚铜共热反应的化学方程式为
3H2SO4(浓)+Cu2O![]() 2CuSO4+SO2↑+3H2O。
2CuSO4+SO2↑+3H2O。


科目:高中化学 来源: 题型:
【题目】如图分别是A、B两种物质的核磁共振氢谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的核磁共振氢谱推测A、B有可能是下面的( )

A. A是C3H6,B是C6H6 B. A是C2H6,B是C3H6
C. A是C2H6,B是C6H6 D. A是C3H6,B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图示。有关该物质的说法中正确的是 ( )

A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
C. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
D. 该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在①苯 ②苯酚 ③甲苯 ④氯乙烷 ⑤乙烯 ⑥乙醇中,(填编号)
<1>能和金属钠反应放出H2的有______ <2>能与NaOH溶液反应的有______
<3>常温下能与溴水反应的有_________ <4>能使酸性KMnO4溶液褪色的烃有_______
II.已知某有机物的结构简式为: ![]()
①该有机物中所含官能团的名称是________________________。
②该有机物发生加聚反应后,所得产物的结构简式为__________。
③写出该有机物发生消去反应的化学方程式(注明反应条件):_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应式为 4NH3+3O2═2N2+6H2O 你认为电解质溶液应显性(填“酸性”“中性““碱性”),写出正极的电极反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.2 mol·L-1的NaOH溶液滴定10.00mL0.2 mol·L-1一元酸HA溶液,溶液的温度和pH随加入NaOH溶液体积(V)的变化曲线如图所示。下列有关说法不正确的是
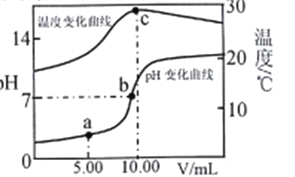
A. HA是弱酸
B. c点水的离子积最大
C. c点后温度降低主要原因是NaA水解吸热
D. 在a、b点之间(不包括b点)一定有c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,下列叙述正确的是

A. 放电过程中,电子从正极转移到负极
B. 放电过程中,H+从正极区移向负极区
C. 正极反应式为:MnO2+4H++2e- =Mn2++2H2O
D. 若C m(H2O)n是葡萄糖,当电路中转移了6NA电子时,消耗的葡萄糖是1mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类:
A.O2和O3 B. ![]() C和
C和![]() C C.CH2=CH-CH3和CH2=CH-CH2-CH3
C C.CH2=CH-CH3和CH2=CH-CH2-CH3
D.淀粉和纤维素 E.葡萄糖和蔗糖
F. G.
G.
(1)互为同位素的是 ________________(填编号,下同);
(2)互为同素异形体的是____________;
(3)互为同分异构体的是____________;
(4)互为同系物的是____________;
(5)同一物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前材料科学的发展方兴未艾。B、N、Ti、Cu、Zn都是重要的材料元素,其单质和化合物在诸多领域都有广泛的应用。
(1)单晶硅太阳能电池片加工时一般掺杂微量的铜,二价铜离子的价电子排布式为_____________。在高温条件下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释__________________。
(2)BF3分子与NH3分子的空间构型为__________、___________,BF3与NH3反应生成的BF3·NH3分子中含有的化学键类型为_________________。
(3)金属Ti的性能优越,能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C_____B(填“>”或“<”,下同),第一电离能:N_______O。
(4)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3),钛酸亚铁与浓硫酸反应生成TiSO4,SO42-中S原子的杂化方式为________,用价层电子对互斥理论解释SO32-的键角比SO42-键角小的原因__________________。
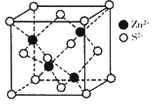
(5)ZnS在荧光体、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为a cm,密度为__________g·cm-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com