
【题目】将下列物质进行分类:
A.O2和O3 B. ![]() C和
C和![]() C C.CH2=CH-CH3和CH2=CH-CH2-CH3
C C.CH2=CH-CH3和CH2=CH-CH2-CH3
D.淀粉和纤维素 E.葡萄糖和蔗糖
F. G.
G.
(1)互为同位素的是 ________________(填编号,下同);
(2)互为同素异形体的是____________;
(3)互为同分异构体的是____________;
(4)互为同系物的是____________;
(5)同一物质是____________。
科目:高中化学 来源: 题型:
【题目】amolFeS与bmolFeO投入VLcmol/L的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为
A. 62(a+b)g B. 186(a+b)g C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素。X、Z和W的原子最外层电子教之和为20。回答下列问题:
(1)X在兀素周期表中的位置是______________。
(2)X和Y元素简单离子的半径较大的是_____(填离子符号);Z和W元素气态氢化物的稳定性较强的是______(填化学式)。
(3)Y的氧化物中既含离子键又含共价键的是_____(用电子式表示)。
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是
A. 同一原子中,能层序数越大,s原子轨道的形状相同,半径越大
B. 在同一能层上运动的电子,其自旋方向肯定不同
C. 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是
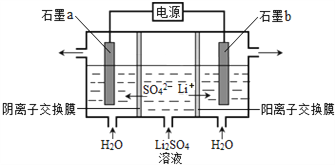
A. b极附近溶液的pH增大
B. a极发生的反应为:2H2O – 4e—= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1 mol电子时,可得到2 molLiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某种软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)为主要原料生产KMnO4的一种流程图如下:
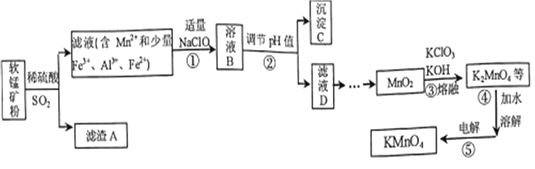
已知:Mn(OH)2极易被空气氧化;Fe(OH)3、Al(OH)3的溶度积常数依次为4.0×10-38、1.3×10-33。
(1)滤渣A的化学式是_________;溶液B中的主要阴离子有______________。
(2)为避免引入杂质,②步调节pH加入的物质是____________;调节pH除杂过程中,后析出的
沉淀是________________。
(3)浓硫酸与MnO2反应也能生成Mn2+,其化学方程式是___________________。
(4) K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,则③步原料应保证_______________。
④步溶解水应煮沸的目的是_____________________。
(5)⑤步的阳极电极反应式是____________;该法电解时要产生污染,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中能大量共存的离子组是( )
A. Ca2+、Na+、NO3-、CO32- B. Na+、Cl-、NH4+、SO42-
C. K+、Cl-、HCO3-、NO3- D. Ca2+、Na+、Fe3+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为CO、CO2、N2等,其中CO含量约占25%左右。
(1)研究表明,由CO可以直接合成多种化工产品,如生产甲醇。
已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1
CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ·mol-1。则CO(g)燃烧热为__________kJ·mol-1。
(2)人体中肌红蛋白(Mb)与血红蛋白(Hb)的主要功能为运输氧气与二氧化碳。肌红蛋白(Mb)可以与小分子X(如氧气或一氧化碳)结合,反应方程式为:Mb(aq)+X(g)![]() MbX(aq)
MbX(aq)
①通常用p表示分子X的压力,p0表示标准状态大气压,若X分子的平衡浓度为p/p0,写出上述反应的平衡常数表达式:K=__________.请用p/p0及K表示吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例__________。
②在常温下,肌红蛋白与CO结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),下图最能代表结合率(f)与此两种气体压力(p)的关系的是____________
③人体中的血红蛋白(Hb)同样能吸附O2、CO2和H+,相关反应方程式及其化学平衡常数分别是:
Ⅰ.Hb(aq)+H+(aq)![]() HbH+(aq);K1
HbH+(aq);K1
Ⅱ.HbH+(aq)+O2(g)![]() HbHO2(aq)+H+;K2
HbHO2(aq)+H+;K2
Ⅲ.Hb(aq)+O2(g)![]() HbO2(aq)K3
HbO2(aq)K3
Ⅳ.HbO2(aq)+H+(aq)+CO2(g)![]() Hb(H+)CO2(aq)+O2(g);△H4
Hb(H+)CO2(aq)+O2(g);△H4
则K3=__________(用K1、K2表示),若低温下反应Ⅳ能自发进行,则该反应△H____0,△S__0(填“>”“<”或“=”)
(3)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=cmol/L,则c(CO32-)=_____mol/L(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com