
【题目】室温下,用0.2 mol·L-1的NaOH溶液滴定10.00mL0.2 mol·L-1一元酸HA溶液,溶液的温度和pH随加入NaOH溶液体积(V)的变化曲线如图所示。下列有关说法不正确的是
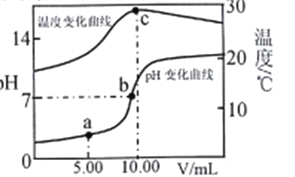
A. HA是弱酸
B. c点水的离子积最大
C. c点后温度降低主要原因是NaA水解吸热
D. 在a、b点之间(不包括b点)一定有c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】C
【解析】A. HA与NaOH恰好反应时,溶液显碱性,说明HA是弱酸,故A正确;B. c点温度最高,生成的盐溶液的浓度最大,水的离子积最大,故B正确;C. c点后温度降低主要原因是反应不再放热,而溶液的质量增大,温度降低,故C错误;D. a点含有等物质的量的HA和NaA,以HA的电离为主,c(A-)>c(Na+)>c(H+)>c(OH-),随着氢氧化钠的加入,到b点时,HA微弱过量,溶液显中性,根据电荷守恒,c(A-) +c(OH-)=c(Na+)+c(H+),则c(A-)=c(Na+)>c(H+)=c(OH-),因此在a、b点之间(不包括b点),一定有c(A-)>c(Na+)>c(H+)>c(OH-),故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.人体缺碘,可通过食用加碘盐补碘
B.缺铁性贫血,可通过食用铁强化酱油预防
C.为了防止龋齿,人人都要长期使用含微量元素氟的牙膏
D.儿童缺锌可导致生长发育不良,抵抗力差,食欲不振
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同主族,B和 D同主族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是_____(填元素符号)。
(2)写出与D同主族元素的氢化物中沸点最髙的物质电子式_______。
(3)单质E与水反应的产物中具有强氧化性物质的结构式_______。
(4)A和E形成的化合物与A和B形成的化合物反应,产物中存在的化学键类型为_______。
(5)C与氧气燃烧的产物投入到水中发生反应的离子方程式为_______。
(6)由A和B、D、E所形成的共价型化合物中,热稳定性最差的物质在足量氧气中燃烧,写出燃烧的化学方程式________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素。X、Z和W的原子最外层电子教之和为20。回答下列问题:
(1)X在兀素周期表中的位置是______________。
(2)X和Y元素简单离子的半径较大的是_____(填离子符号);Z和W元素气态氢化物的稳定性较强的是______(填化学式)。
(3)Y的氧化物中既含离子键又含共价键的是_____(用电子式表示)。
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数依次增大的X、Y、Z、D、E、F六种前四周期元素。X是宇宙中最丰富的元素;Y和Z基态原子的未成对电子数均等于周期序数;D的氧化物是典型的两性氧化物;E是所在周期中电负性最大的元素;F的单质是一种紫红色金属,在潮湿空气中该金属表面会慢慢生成一种绿色固体。请回答下列问题(用元素符号或化学式表示):
(1)X元素位于周期表的________区。
(2)基态D原子的价电子轨道表示式是______,其第一电离能反常地低于同周期前一种元素,原因是_______。
(3)YZ2分子的电子式是__________,该分子的空间构型是_____________。
(4)甲是由X、Y、Z三种原子构成的含有16个电子的分子,甲中Y原子的杂化类型是_______,它能溶于水的原因是______________。
(5)金属F与XE的热浓溶液反应产物之一是X3[FE4],该反应的化学方程式是______________。
(6)F与Z形成的一种晶胞结构如图,其中F原子均匀地分散在立方体内部,原子a、b、d的坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() )、(3m,3m,3m),则m=________。已知该晶体的密度为ρg/cm3, NA是阿伏伽德罗常数值,则原子b和d之间的核间距是__________nm(列出计算式即可)。
)、(3m,3m,3m),则m=________。已知该晶体的密度为ρg/cm3, NA是阿伏伽德罗常数值,则原子b和d之间的核间距是__________nm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是
A. 同一原子中,能层序数越大,s原子轨道的形状相同,半径越大
B. 在同一能层上运动的电子,其自旋方向肯定不同
C. 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态
D. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向K2SO4和FeCl3混合溶液中滴入Ba(OH)2溶液,当SO42-离子完全沉淀时,Fe3+也同时被完全沉淀,则原混合溶液中K2SO4和FeCl3的物质的量浓度之比为( )
A. 1:1 B. 2:1 C. 3:1 D. 3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com