
科目:高中化学 来源: 题型:
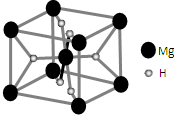 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 常见元素A、B、C、D,其原子结构的相关信息如下表:
常见元素A、B、C、D,其原子结构的相关信息如下表:| 元素 | 相关信息 |
| A | 核外电子总数等于该基态原子电子层数 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 基态原子L电子层中有3个未成对电子 |
| D | 生活中大量使用的合金制品,工业上可用电解其氧化物的方法制取其单质 |
| E | 外围电子排布为(n+1)d3n(n+2)sn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点(℃) | 密度(g/cm3) | 硬度(金刚石为10) | 导电性(银为100) | |
| 某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
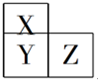 X、Y、Z、T、V为5种短周期元素,X、Y、Z在周期表中位置如图所示,这三种元素原子序数之和是41,X和T在不同条件下反应,可以生成化合物T2X(白色固体)和T2X2(淡黄色固体)两种化合物,V单质在Z单质中燃烧产生苍白色火焰,产物溶于水能使石蕊试液变红,则:
X、Y、Z、T、V为5种短周期元素,X、Y、Z在周期表中位置如图所示,这三种元素原子序数之和是41,X和T在不同条件下反应,可以生成化合物T2X(白色固体)和T2X2(淡黄色固体)两种化合物,V单质在Z单质中燃烧产生苍白色火焰,产物溶于水能使石蕊试液变红,则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Ba2+、NO3-、CO32- |
| B、Na+、OH-、SO42-、MnO4- |
| C、Na+、Fe3+、Cl-、AlO2- |
| D、K+、Mg2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com