
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
a | |||||||||||||||||
b | c | d | |||||||||||||||
e | f | g | h | i | |||||||||||||
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2) i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物是溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
【答案】(1)O2->Na+>Al3+HNO3>H2CO3>H2SiO3HCl>H2S>SiH4
(2)HClO4OH-+H+= H2O MnO2 + 4HCl(浓)![]() MnCl2 + Cl2 ↑+ 2H2O
MnCl2 + Cl2 ↑+ 2H2O
(3)Al(OH)3+OH-= AlO2-+2H2O
(4)离子键和非极性共价键 Na2O2+SO2=Na2SO4
【解析】试题分析:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Na、f为Al、g为Si、h为S、i为Cl。(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:O2->Na+>Al3+;非金属性N>C>Si,故酸性:HNO3>H2CO3>H2SiO3,非金属Cl>S>Si,故氢化物稳定性:HCl>H2S>SiH4。(2)i元素的最高价氧化物对应的水化物为高氯酸,化学式为HClO4,e的最高价氧化物对应水化物为氢氧化钠,二者反应生成高氯酸钠与水,离子方程式为:OH-+H+=H2O,实验室制取用二氧化锰与浓盐酸在加热条件下制备氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2 + Cl2 ↑+ 2H2O。(3)氢氧化铝属于两性氢氧化物,与强碱反应生成偏铝酸盐与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O。(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键、共价键;h的低价态氧化物为二氧化硫,与过氧化钠反应生成硫酸钠,反应方程式为:Na2O2+SO2=Na2SO4。
MnCl2 + Cl2 ↑+ 2H2O。(3)氢氧化铝属于两性氢氧化物,与强碱反应生成偏铝酸盐与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O。(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键、共价键;h的低价态氧化物为二氧化硫,与过氧化钠反应生成硫酸钠,反应方程式为:Na2O2+SO2=Na2SO4。


科目:高中化学 来源: 题型:
【题目】在一定温度下,固定体积的密闭容器内,反应2HI(g)![]() H2 (g)+ I2 (g)达到平衡状态的标志是:( )
H2 (g)+ I2 (g)达到平衡状态的标志是:( )
①I2的体积分数不再变化;
②生成1 mol H2同时消耗1 molI2;
③容器内压强不再变化;
④生成2 mol HI同时消耗1molH2;
⑤气体的密度不再变化;⑥混合气体的平均分子质量不再变化
A.①②③④⑤⑥ B.①②③⑤⑥ C.①②⑤⑥ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50ml溶液,然后用0.05mol/L盐酸与它反应,得到图象如下(已知:1mol=1000mmol)
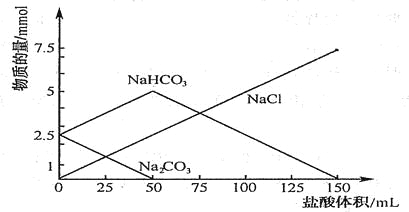
(1)盐酸加到25ml时溶液中发生反应的化学方程式 .
(2)原混合物中Na2CO3物质的量为 mol
(3)盐酸加到150ml时,放出标准状况下气体 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出铁与水蒸气反应的化学方程式______________________________。
(2)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
Cu2S+ HNO3 ![]() CuSO4 + Cu(NO3)2+ NO↑+
CuSO4 + Cu(NO3)2+ NO↑+
(3)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有原子可能都在同一平面上 B. 最多只可能有9个碳原子在同一平面
C. 有7个碳原子可能在同一直线 D. 只可能有5个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是( )

A.有机物A属于芳香烃
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.1mol A和足量的NaOH溶液反应,可以消耗3mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。
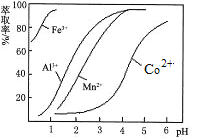
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是

A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1 mol化合物X最多能与2 molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知杯芳烃是由苯酚和甲醛经缩合反应而生成的一类环状化合物,因其分子形状与希腊圣杯相似,且是由多个苯环构成的芳香族分子,由此得名。杯芳烃以“杯[n]芳烃”的形式命名,n是芳环的数目。下图所示的是叔丁基[—C(CH3)3]取代的杯[n]芳烃的结构简式。

回答下列问题:
(1)杯[n]芳烃的通式是: ;
(2)若叔丁基取代的杯[n]芳烃在光照情况下和氯气反应时不取代苯环上的氢和酚羟基上的氢,则其一氯代物有 种;若存在叔丁基取代的杯[2015]芳烃,则光照情况下,其二氯代物有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com