
| 2200℃~2300℃ |
| HgCl2 |
| 140℃~200℃ |
| 2.24L |
| 22.4L/mol |
| 2.24L |
| 22.4L/mol |
| 0.2mol |
| 2mol/L |
| △ |
| ||
| 催化剂 |
| △ |
| △ |
| ||
| 催化剂 |
| △ |


科目:高中化学 来源: 题型:
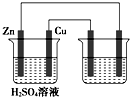 如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )| A、铜在原电池中作负极,在电镀池中作阳极 |
| B、原电池溶液增加的质量比电镀池阴极增加的质量大 |
| C、锌棒每减少0.65 g,导线上转移的电子约为1.204×1022个 |
| D、电路中电子的移动方向是从Zn沿导线到电镀池的铜极,再经过溶液到铁棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L |
| B、0.6 mol/L |
| C、1 mol/L |
| D、2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、①③ |
| C、②④⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
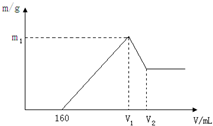 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热. | / |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中. | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com