
 HOI(aq) △H2
HOI(aq) △H2 I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3 I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.


| A.c(H+)减小 | B.c(I-)减小 | C.I2(g)不断生成 | D.c(Fe3+)增加 |
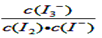
 I3-(aq)的平衡右移,消耗的c(I-)增多,提高Ⅰ-的转化率。
I3-(aq)的平衡右移,消耗的c(I-)增多,提高Ⅰ-的转化率。 I3-(aq),平衡常数表达式为
I3-(aq),平衡常数表达式为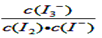 。
。 I3-(aq)的平衡右移,二者导致消耗的c(I-)增多,所以I?的转化率增大。
I3-(aq)的平衡右移,二者导致消耗的c(I-)增多,所以I?的转化率增大。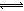 I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)
I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)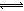 I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)减小,使 I2(aq)+I-(aq)
I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)减小,使 I2(aq)+I-(aq)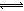 I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-氧化成I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)
I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-氧化成I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)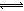 I3-(aq)的平衡右移,I3-浓度增大,D项错误。
I3-(aq)的平衡右移,I3-浓度增大,D项错误。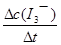 =
=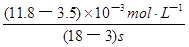 ≈5.5×10-4mol/(L?s),
≈5.5×10-4mol/(L?s),

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.燃料的燃烧反应都是放热反应 |
| B.绿色植物进行光合作用时,能把光能转化为化学能 |
| C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 |
| D.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,则说明相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放热92.4kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

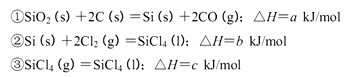
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放热反应在任何条件都能自发进行 |
| B.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol  CH3OH(g) + H2O(l) ΔH2
CH3OH(g) + H2O(l) ΔH2 | | 2min | 4min | 6min | 8min | … |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,则吸入肺部CO的浓度不能超过______mol·L-1。
,则吸入肺部CO的浓度不能超过______mol·L-1。 FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1 FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2 CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3| T/℃ | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
 CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g)
CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com