
【题目】研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。

①下列事实能说明该反应一定达到平衡的是____。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______,理由是____。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________。
【答案】(1)+160kJ·mol-1 (2)①ac②p4>p1>p2>p3反应前后气体分子数增大,相同温度下,压强升高,甲烷的平衡转化率降低③12.6p42
(3)0.1mol·L-14×10-9 (4)2CN-+5CIO-+H2O=2CO2↑+N2↑+5CI-+2OH-
【解析】
试题分析:(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1
则根据盖斯定律可知③-②-①即得到CH4(g)+CO2(g)= 2CO(g)+2H2(g)的△H=+160kJ·mol-1。
(2)①a.CO2的浓度不在发生变化说明反应达到平衡状态,a正确;b.v(CH4)=2v(CO)没有指明反应的方向,气味不能满足反应速率之比是化学计量数制备,则没有达到平衡状态,b错误;c.气体的质量不变,但物质的量变化,因此混合气体的平均相对分子质量不发生变化说明反应达到平衡状态,c正确;d.CO与H2的物质的量比为1:1不能说明反应达到平衡状态,d错误,答案选ac。
②反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)为气体分子数增加的反应,当温度一定时,减小压强,可增大CH4的转化率,从图像可知,相同温度下,按p4、p1、p2、p3的顺序CH4的转化率增大,所以p4>p1>p2>p3。③在恒容密闭容器中通入n mol CH4与,n mol CO2,反应在图象中X点的甲烷转化率为50%,
2CO(g)+2H2(g)为气体分子数增加的反应,当温度一定时,减小压强,可增大CH4的转化率,从图像可知,相同温度下,按p4、p1、p2、p3的顺序CH4的转化率增大,所以p4>p1>p2>p3。③在恒容密闭容器中通入n mol CH4与,n mol CO2,反应在图象中X点的甲烷转化率为50%,
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始量(mol) n n 0 0
变化量(mol) 0.8n 0.8n 1.6n 1.6n
平衡量(mol) 0.2n 0.2n 1.6n 1.6n
则P(CH4)=P(CO2)=![]()
P(CO)=P(H2)=![]()
Kp=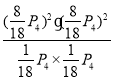 =12.6p42
=12.6p42
(3)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O![]() (NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,则
(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,则
NH4++H2O![]() H++NH3H2O
H++NH3H2O
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=![]() =4×10-9。
=4×10-9。
(4)用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,气体是氮气和CO2,所以该反应的离子方程式2CN-


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+ = Cu2++H2↑
B.向CH3COOH溶液中加入CaCO3:2 CH3COOH+CaCO3 = 2 CH3COO-+Ca2++H2O+CO2↑
C.稀硫酸与Ba(OH)2溶液混合:H++ SO![]() +OH-+ Ba2+ = BaSO4↓+H2O
+OH-+ Ba2+ = BaSO4↓+H2O
D.NaOH溶液与KHCO3溶液混合:OH- + HCO3- = H2O +CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是

A. 乙烧杯中发生还原反应
B. 甲烧杯中溶液的pH逐渐减小
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. 外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的核心是在化学反应过程中或化工生产中,尽量减少使用或彻底消除有害物质,下列做法中,符合“绿色化学”理念的是( )
A.生产和使用剧毒农药
B.化工厂产生的废气向高空排放
C.利用氢气作高能燃料
D.造纸厂利用二氧化硫进行纸浆漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O
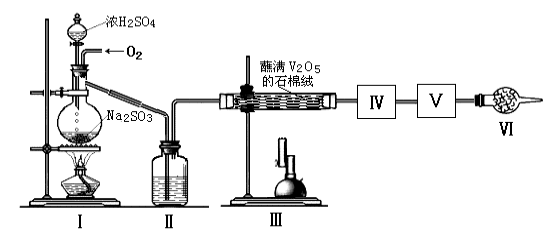
(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
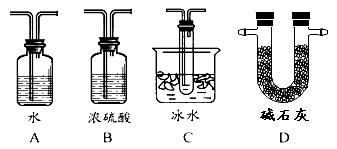
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用18.9gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了7.2g,则实验测得SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A、100mL量筒
B、托盘天平
C、玻璃棒
D、50mL容量瓶
E、10mL量筒
F、胶头滴管
G、50mL烧杯
H、100mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有 (填字母)
(3)下列操作会导致所配溶液浓度偏低的是________(填序号)
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶使用前未进行干燥
④没有洗涤溶解时所用的烧杯和玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com