
【题目】下列说法正确的是 ( )
A.硫酸、纯碱、碳酸氢钠和生石灰分别属于酸、碱、盐和氧化物
B.用丁达尔效应区别FeCl3溶液和Fe(OH)3胶体
C.生石灰与水混合的过程只发生物理变化
D.H2O、CH3COOH、Cu(NH3)4SO4均含有氧,都是氧化物
科目:高中化学 来源: 题型:
【题目】水溶液中能大量共存的一组离子是( )
A.Na+、Al3+、Cl﹣、CO32﹣
B.H+、Na+、Fe2+、MnO4﹣
C.K+、Ca2+、Cl﹣、NO3﹣
D.K+、NH4+、OH﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应限度的说法中正确的是
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生能量而存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①下图能表示该反应过程中能量变化的是________(填字母)。
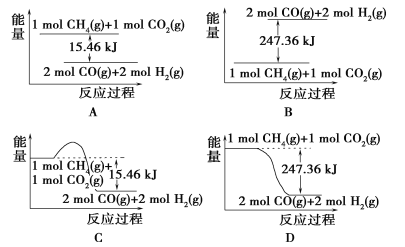
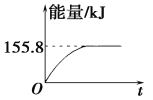
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成C与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态C合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl2、CuCl广泛用于有机合成的催化剂。CuCl2容易潮解; CuCl白色粉末,微溶于水,溶于浓盐酸和氨水生成络合物,不溶于乙醇。
已知:
i.CuCl2+Cu+2HCl(浓)![]() 2H[CuCl2](无色)
2H[CuCl2](无色)![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
ii.副反应:CuCl+H2O![]() CuOH+2HCl;CuCl+Cl—===[CuCl2]—
CuOH+2HCl;CuCl+Cl—===[CuCl2]—
(1)制取CuCl2装置如下:
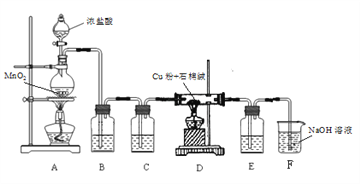
① A装置中发生反应的离子方程式是_________。
② C、E 装置中盛放的是浓硫酸,作用是_________。
③ B中选择饱和食盐水而不用蒸馏水的原因是_________。
(2)制取CuCl流程如下:
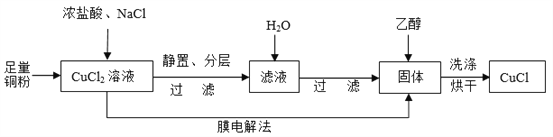
①反应①中加入NaCl的目的是_________;但是Cl—浓度过高,CuCl产率降低,原因是________________。
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为________________。
③利用膜电解法制取CuCl,阴极电极反应式为________________。
④用乙醇洗涤沉淀Y的原因为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com