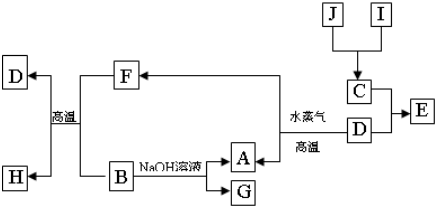
解:I的浓溶液具有还原性,应为HCl,J是一种黑色固体,可与浓盐酸反应,应为MnO
2,二者反应生成C为Cl
2,D为常见金属,可与水蒸气反应,应为Fe,则E为FeCl
3,A为H
2,F为Fe
3O
4,B能与Fe
3O
4在高温下反应,且能与NaOH溶液反应,则B为
Al,G为NaAlO
2,H为Al
2O
3,则
(1)由以上分析可知C为Fe,位于周期表第三周期、第ⅦA族,故答案为:第三周期、第ⅦA族;
(2)F为Fe
3O
4,B为Al,二者在高温下发生铝热反应,方程式为8Al+3Fe
3O
4
9Fe+4Al
2O
3,
故答案为:8Al+3Fe
3O
4
9Fe+4Al
2O
3;
(3)实验室可用将饱和FeCl
3溶液逐滴加入沸水的方法制备氢氧化铁胶体,可继续加热至液体变为红褐色时停止解热,
反应的方程式为Fe
3++3H
2O

Fe(OH)
3(胶体)+3H
+,胶体不能透过半透膜,可用渗析的方法分离,
a.胶体具有丁达尔效应,光束通过该液体时形成光亮的“通路”,故a正确;?
b.胶体遇电解质溶液首先发生聚沉,继续加入HI酸,发生中和反应,后沉淀逐渐溶解,生成Fe
3+,具有氧化性,溶液中生成I
2,再滴入几滴淀粉溶液,溶液变为蓝色,故b正确;
c.溶液中含有Cl
-,向该液体中加入硝酸银溶液,生成AgCl沉淀,故c错误;
d.将该液体加热发生水解生成Fe(OH)
3、蒸干、灼烧,Fe(OH)
3分解得红棕色固体Fe
2O
3,故d正确,
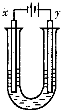
胶体具有电泳现象,胶体粒子带正电荷,外加电源,可向电源负极移动,则x极红色加深,?
故答案为:将饱和FeCl
3溶液逐滴加入沸水中,继续加热至液体变为红褐色;Fe
3++3H
2O

Fe(OH)
3(胶体)+3H
+;渗析;abd;红褐色加深;
(4)氢氧化铁胶体聚沉生成沉淀,与盐酸发生中和反应,反应的离子方程式为Fe(OH)
3+3H
+=Fe
3++3H
2O,
故答案为:Fe(OH)
3+3H
+=Fe
3++3H
2O;
(5)G为NaAlO
2,为强碱弱酸盐,发生水解:AlO
2-+2H
2O

Al(OH)
3+OH
-,溶液呈碱性,
故答案为:碱;AlO
2-+2H
2O

Al(OH)
3+OH
-;
(6)根据题意可知反应的离子方程式为MnO
2+H
2O
2+2H
+═Mn
2++O
2↑+2H
2O,故答案为:MnO
2+H
2O
2+2H
+═Mn
2++O
2↑+2H
2O;
分析:I的浓溶液具有还原性,应为HCl,J是一种黑色固体,可与浓盐酸反应,应为MnO
2,二者反应生成C为Cl
2,D为常见金属,可与水蒸气反应,应为Fe,则E为FeCl
3,A为H
2,F为Fe
3O
4,B能与Fe
3O
4在高温下反应,且能与NaOH溶液反应,则B为Al,G为NaAlO
2,H为Al
2O
3,结合相关物质的性质解答该题.
点评:本题考查无机物的推断,题目难度中等,解答本题时注意根据“J是一种黑色固体,I的浓溶液具有还原性,”等信息为突破口,注意把握相关物质的性质.



 9Fe+4Al2O3,
9Fe+4Al2O3, 9Fe+4Al2O3;
9Fe+4Al2O3; Fe(OH)3(胶体)+3H+,胶体不能透过半透膜,可用渗析的方法分离,
Fe(OH)3(胶体)+3H+,胶体不能透过半透膜,可用渗析的方法分离, Fe(OH)3(胶体)+3H+;渗析;abd;红褐色加深;
Fe(OH)3(胶体)+3H+;渗析;abd;红褐色加深; Al(OH)3+OH-,溶液呈碱性,
Al(OH)3+OH-,溶液呈碱性, Al(OH)3+OH-;
Al(OH)3+OH-;

 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:

 Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-
Al(OH)3+OH-

 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为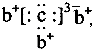 下列比较中正确的是( )
下列比较中正确的是( )