
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
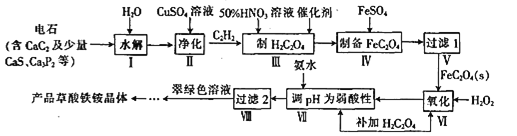
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
【答案】![]() 4:1
4:1 ![]() 升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化 取最后一次洗涤液少许滴入盐酸酸化的
升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化 取最后一次洗涤液少许滴入盐酸酸化的![]() 溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净 草酸过量,使溶液中
溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净 草酸过量,使溶液中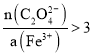 ,从而得到更多的产品 加热(蒸发)浓缩 冷却结晶
,从而得到更多的产品 加热(蒸发)浓缩 冷却结晶
【解析】
(1)CaC2中碳碳共用三对电子,因此可以书写电子式。
(2)根据氧化还原反应化合价升降守恒分析得出。
(3)根据反应信息和氧化还原反应得到化学方程式,由于浓度越大,温度越高,硝酸氧化性越强,易将草酸氧化。
(4)沉淀表面有硫酸根杂质,检验其是否洗涤干净,主要是验证最后一次洗液中是否有硫酸根。
(5)步骤Ⅵ、VII补加草酸,增加草酸浓度,有利于平衡向生成草酸铁铵方向移动得到更多产品。
(6)步骤VIII由滤液制得产品,从溶液到晶体遵循一般采用蒸发浓缩、冷却结晶等。
(1)CaC2的电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,,PH3中P化合价升高8个价态,作还原剂,CuSO4中Cu化合价降低2个,作氧化剂,根据化合价升降守恒,因此该反应中氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1。
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为3C2H2+8HNO3 ![]() H2C2O4+4 H2O+8NO,硝酸具有强氧化性,浓度越大,温度越高,氧化性越强,易将草酸氧化,因此硝酸的浓度及反应温度都不宜过高,是因为升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化,故答案为:3C2H2+8HNO3
H2C2O4+4 H2O+8NO,硝酸具有强氧化性,浓度越大,温度越高,氧化性越强,易将草酸氧化,因此硝酸的浓度及反应温度都不宜过高,是因为升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化,故答案为:3C2H2+8HNO3 ![]() H2C2O4+4 H2O+8NO;升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化。
H2C2O4+4 H2O+8NO;升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化。
(4)“过滤1”需对沉淀进行洗涤,沉淀表面有硫酸根杂质,检验其是否洗涤干净,主要是验证最后一次洗液中是否有硫酸根,其依据是取最后一次洗涤液少许滴入盐酸酸化的BaCl2溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净,故答案为:取最后一次洗涤液少许滴入盐酸酸化的BaCl2溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净。
(5)步骤Ⅵ、VII补加草酸,增加草酸浓度,有利于平衡向生成草酸铁铵方向移动,因此目的是草酸过量,使溶液中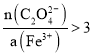 ,从而得到更多的产品,故答案为:草酸过量,使溶液中
,从而得到更多的产品,故答案为:草酸过量,使溶液中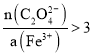 ,从而得到更多的产品。
,从而得到更多的产品。
(6)步骤VIII由滤液制得产品,溶液到晶体一般的操作为加热(蒸发)浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:加热(蒸发)浓缩、冷却结晶。


科目:高中化学 来源: 题型:
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:

(1)组成青蒿素的三种元素电负性由大到小排序是 ,在基态O原子中,核外存在 对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是 (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH + B(OCH3)3 → NaBH4+ 3CH3ONa
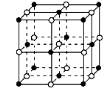
① NaH为 晶体,右图是NaH晶胞结构,则NaH晶体的配位数是 ,若晶胞棱长为a则Na原子间最小核间距为 。
② B(OCH3)3 中B采用的杂化类型是 。写出两个与B(OCH3)3 具有相同空间构型的分子或离子 。
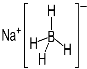
③ NaBH4结构如图所示。结构中存在的作用力有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成卤化物,叠氮化物及配合物等许多化合物。下列说法不正确的是( )
A.NF3分子的空间构型为三角锥形
B.叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-,则N2O与N3-互为等电子体
C.叠氮化物与Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,则其中钴的配位数为8
D.NaN3与KN3的结构类似,则NaN3的晶格能大于KN3的晶格能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是![]()
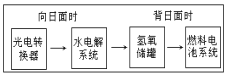
A.该能量转化系统中的水也是可能循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极有![]() 放出
放出
D.燃料电池放电时的负极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的有
A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
B.电解饱和食盐水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.氯气通入冷水中 Cl2 +H2O = Cl-+ClO-+2H+
D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<0
2CO2(g)+N2(g)△H<0
①反应的速率-时间图像如图甲所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图乙所示。以下说法正确的是___________(填对应字母)。
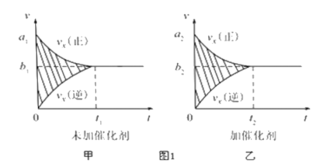
A. a1>a2 B.b1<b2 C.t1>t2 D.图乙中阴影部分面积更大E.图甲中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol
N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:______________。
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是_________反应(填“吸热”或“放热”)。
②T℃时,向1L密闭容器中投入lmolCH4和lmolH2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K=______________。
CO+3H2的平衡常数K=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是分解反应的产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
D.饱和溶液一定比不饱和溶液的浓度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。
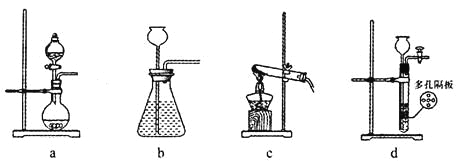
(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:
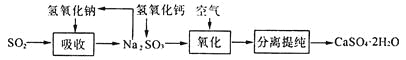
上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com