
Àƒäãá¢À¢ŸãùÃáóƒÏäÍ(Na2MoO4ÀÊ2H2O)¢èØøøó§Þò¶¡₤òÇÀÈØåŸãƒ¨¢µ(ø¼Øˆ°èñøöˆMoS2Ș¤˜èìê¢åÆøò)öˆåÙêüȘøóÝ¡ŸãùÃáóƒÏäÍçáø¼Øˆê¼°äë¥àÓüôÀÈ

£ÄÇÞüôêÅöòäã
È´1Èˋëõ°èüôêÅñÇÆÎȤ_____MoS2+ _____O2![]() _____SO2+ _____MoO3
_____SO2+ _____MoO3
åÖݤèíô₤øÅȘ¢íó½ÇÆô₤çæ§½àŠ¢µò₤ƒÙñÜùÕ¤µÇÆô₤Ñ˧½àŠÈ˜íãîªÇÎâÚçáá¢çáòú__________________ÀÈ
È´2Èˋé´¯ÝùÛ§±àÀÇøýºóñ£þçû(NH4)2MoO4àÉؤȘóð£₤îÏñÇÆÎñ§°äò§öˆ____________________________È£¡ûñÇÆÎùçû¼MoO3______È´äŸÀ¯ÆÅÀÝ£·À¯û£ÆÅÀÝÈˋùÃÅåî¾£₤öÿçáÅåøòÀÈ
È´3Èˋ°ÈöôüôȘ°êŸã§æÑöùªçûñüؤöˆ(NH4)2SO4üÀàÉؤÀÈà¶(NH4)2SO4üÀàÉؤçápH=aȘå·![]() =_______È´Æû¤˜açáǺò»ò§ÝÚòƒÈ˜NH3ÀÊH2OçáKb=1.8Àê10-5ÈˋȘට¨ÇùüÀàÉؤí¶ñÂé´ù¾È˜
=_______È´Æû¤˜açáǺò»ò§ÝÚòƒÈ˜NH3ÀÊH2OçáKb=1.8Àê10-5ÈˋȘට¨ÇùüÀàÉؤí¶ñÂé´ù¾È˜![]() §¨_________È´äŸÀ¯ÝðǵÀÝÀ¯ý£ÝðÀÝ£·À¯ÝðÅÀÀÝÈˋÀÈ
§¨_________È´äŸÀ¯ÝðǵÀÝÀ¯ý£ÝðÀÝ£·À¯ÝðÅÀÀÝÈˋÀÈ
È´4ÈˋØîøˆŸãùÃáóåÖأѴöôÑàñÑöÏáÖçáö—°—öÿøò¥¯üÁÆÎöÿøòçáàɧãÑààÓüôÝÚùªòƒÈ˜£þçûNa2MoO4ÀÊ2H2Oçáýìæ¼öˆ_____________ÀÈ
öôÑà(ÀÌ) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
ö—°—öÿøò | Na2MoO4ÀÊ10H2O | Na2MoO4ÀÊ2H2O | ||||||
àɧãÑà | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
§ÃƒÏçûç§çáá¡Ø¤¢èØååÖüôÇö§ÃƒÏòÝøÄ¡Çò¿ÆûȘç¨Çÿç§Ø£Ñ´Çöò»¤µÝÄÅŠƒ££₤ÇÎâÚȘåÙØ·òú_____________ÀÈ
È´5Èˋ¢íó½øÅŸãùÃîöÑå䥡øçᣤòÇåÙâÚòúåÖ¡øäºÝÚûÌÅö°èFeMoO4-Fe2O3ÝÈ£ÊáÊȘåÖûÉÝíò§îÙ£ñâðàÇùÛüçë°øÅçá䥡ø¿Éç⣤òÇȘ°»ÅÒ¥ÆàŠŸãùÃîöë㣿ÅÒ¥ÆàŠçáöÿøòòú___________(äŸîÀüŸæøá¡)ÀÈ
A. NaNO2 B.ë´àŠòòê¢N2 C.Æëø˜ D.îöùÃ
ÀƒÇÞ¯¡À¢ 2 7 4 2 å—ǵ¿äó½§ÆÇËûÌ£»È˜äáÔåÙêüâ«Æûôò(¥Æ¢šñÇÆÎùìôòØÁ¢è) MoO3+2NH3ÀÊH2O=(NH4)2MoO4+H2O ÆÅ 1.8Àê109-a Ýðǵ í¶ñÂé´ù¾È˜¢ÄøóåÖ15.5ÀÌØåèü(£·15.5 ÀÌ~100ÀÌ)§½ÅÅ¿»ôù(üÇçÆÀÂêâ¡è) á¡Ø¤øÅçáNaOHé´Ñàå§âÇå§ÇµÈ˜æŸ¤µ§ÃƒÏäÃÇ¢òÝùÌNa2MoO4ÀÊ2H2Oö—°— A
Àƒ§ãö—À¢È´1Èˋ¡ªƒïî¾£₤£¿åÙñÇÆΣ₤¤ü¥Ü軧çüÁçà¿ÌôèȤMoÆè+4¥Ü軡Ôç§+6¥ÜȘSÆè-2¥Ü軡Ô+4¥ÜȘ¿ý軡Ô[6-4+2ÀêÈ´4+2Èˋ]=14¥ÜȘOÆè0¥Ü§ççëç§-2¥ÜȘ¿ý§ççë4¥ÜȘæŸÅÀ¿¨ÝÑò»öˆ28È£ùªØåMoS2üçò»öˆ2ȘO2üçò»7Ș¡ªƒïåÙæÆòĤЧ½ÅÅéðó§È˜ƒÔäÍàÓüôȤ2MoS2+7O2![]() 4SO2+ 2MoO3È£åÖݤèíô₤øÅȘ¢íó½ÇÆô₤çæ§½àŠ¢µò₤ƒÙñÜùÕ¤µÇÆô₤Ñ˧½àŠÈ˜¢èØåå—ǵ¿äó½§ÆÇËûÌ£»È˜äáÔåÙêüâ«ÆûôòȘ¥Æ¢šñÇÆÎùìôòÈ£í»àñÇÞ¯¡È¤2 7 4 2È£å—ǵ¿äó½§ÆÇËûÌ£»È˜äáÔåÙêüâ«Æûôò(¥Æ¢šñÇÆÎùìôòØÁ¢è)ÀÈ
4SO2+ 2MoO3È£åÖݤèíô₤øÅȘ¢íó½ÇÆô₤çæ§½àŠ¢µò₤ƒÙñÜùÕ¤µÇÆô₤Ñ˧½àŠÈ˜¢èØåå—ǵ¿äó½§ÆÇËûÌ£»È˜äáÔåÙêüâ«ÆûôòȘ¥Æ¢šñÇÆÎùìôòÈ£í»àñÇÞ¯¡È¤2 7 4 2È£å—ǵ¿äó½§ÆÇËûÌ£»È˜äáÔåÙêüâ«Æûôò(¥Æ¢šñÇÆÎùìôòØÁ¢è)ÀÈ
È´2ÈˋMoO3ÆŠNH3ÀÊH2OñÇÆÎ躰è(NH4)2MoO4Ș£₤îÏñÇÆÎñ§°äò§öˆMoO3+2NH3ÀÊH2O=(NH4)2MoO4+H2OÈ£ùÃÅåî¾£₤öÿòúø¡ÆŠ¥ŸñÇÆÎ躰èîö¤ëùÛȘñÂèºñúî¾£₤£¿åÙñÇÆÎÈ˜í«¡—ñÇÆο»°äȘ¡¼åˆùÄ£₤¤ü¥Üƒªû£ñÂèºÝð£₤ȘùªØåMoO3ÆÅùÃÅåî¾£₤öÿçáÅåøòÈ£í»àñÇÞ¯¡È¤MoO3+2NH3ÀÊH2O=(NH4)2MoO4+H2OÈ£ÆÅÀÈ
È´3Èˋê·ùÃÿÏùÛ§ãüåùÃÅåȘùÛ§ãó§¤ã°Èò»öˆKh=Kw/Kb=c(NH3H2O)Àêc(H+)/c(NH4+),ùªØåc(NH3H2O)/c(NH4+)=Kw/[KbÀêc(H+)], c(H+)=10-amol/LȘùªØåc(NH3H2O)/c(NH4+)=10aKw/KbȘ![]() = Kb/10aKw=1.8Àê10-5/10aÀê10-14=1.8Àê109-aȣට¨(NH4)2SO4üÀàÉؤí¶ñÂé´ù¾È˜àɥ꥾ÅÀȘé´Ñàå—ǵȘNH4+ùÛ§ãáÉêÎ¥¾à¾È˜ùªØå
= Kb/10aKw=1.8Àê10-5/10aÀê10-14=1.8Àê109-aȣට¨(NH4)2SO4üÀàÉؤí¶ñÂé´ù¾È˜àɥ꥾ÅÀȘé´Ñàå—ǵȘNH4+ùÛ§ãáÉêÎ¥¾à¾È˜ùªØå![]() §¨Ýðǵȣí»àñÇÞ¯¡È¤1.8Àê109-aÈ£ÝðǵÀÈ
§¨Ýðǵȣí»àñÇÞ¯¡È¤1.8Àê109-aÈ£ÝðǵÀÈ
È´4Èˋ¡ªƒïä㡽ë¥ÝÚÅéü¢èøˆÈ˜öôÑà¢ÄøóåÖ15.5 ÀÌ~100ÀÌøÛ¥ðȘÑåŸãùÃáóàÉؤ§½ÅÅí¶ñÂé´ù¾È˜¢èØåçûç§Na2MoO4ÀÊ2H2OȘࣤµ§½ÅÅ¿»ôùÀÂüÇçÆÀÂêâ¡èçàýìæ¼È£Ø·öˆ¥ÆààȘ£ÃÇ짽Na2MoO4çáùÛ§ãȘ§½ÅÅÑÁÇöøÄ¡Çýì漤µÈ˜á¡Ø¤øÅçáNaOHé´Ñàå§âÇå§ÇµÈ˜Øý£ÃùÌæéNa2MoO4ÀÊ2H2Oö—°—È£í»àñÇÞ¯¡È¤í¶ñÂé´ù¾È˜¢ÄøóåÖ15.5ÀÌØåèü(£·15.5 ÀÌ~100ÀÌ)§½ÅÅ¿»ôù(üÇçÆÀÂêâ¡è)È£á¡Ø¤øÅçáNaOHé´Ñàå§âÇå§ÇµÈ˜æŸ¤µ§ÃƒÏäÃÇ¢òÝùÌNa2MoO4ÀÊ2H2Oö—°—ÀÈ
È´5ÈˋŸãùÃáóàÉؤùÛ§ãü奟ÅåȘîúü¾ùÃáóàÉؤùÛ§ãü奟ÅåȘ¥ÆàŠNaNO2¢èØåØøøóŸãùÃáóçáùÛ§ãȘѽë´àŠçˆó½ÀÂ¥ÆàŠÆëø˜È˜óÞ秡¶ƒ½¢íó½çáæ¼ÆûȘîöùÃáÉ¿£ŸãùÃáóñÇÆÎȘóÞý£ç§ØøøóŸãùÃáóùÛ§ãçáæ¼ÆûÈ£í»àñîÀüŸAÀÈ


 53ùÌäûýãüçêÅÇÞ¯¡
53ùÌäûýãüçêÅÇÞ¯¡
| áõ¥Ñ | ¡ÔøÅ¢ö°ä | áõ¥Ñ | °¾øÅ¢ö°ä |
| ¡ÔØ£ | ¡ÔØ£ûãñî¢ö°äëó¥—ÈÀ | °¾Ø£ | °¾Ø£ûãñî¢ö°äëó¥—ÈÀ |
| ¡Ôѱ | ¡Ôѱûãñî¢ö°äëó¥—ÈÀ | °¾Ñ± | °¾Ñ±ûãñî¢ö°äëó¥—ÈÀ |
| ¡Ôà» | ¡Ôà»ûãñî¢ö°äëó¥—ÈÀ | °¾à» | °¾à»ûãñî¢ö°äëó¥—ÈÀ |
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢ößùÛôà£₤¡óòúØ£øø¥ÜêÛÀÂÆéøòçá¡èåÿ¥êȘôà£₤¡óò¶ÆÖ
A. ùà B. ¥Ÿ C. îö D. £š¤üöÿ
ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢üôêÅöÿøòçáø¼Øˆ°èñøý£ò¶ÆÖäšà£¡ÔñøæÆçáòú
A. çÚñÜ B. ýüù¢ C. Æëø˜ D. üùö˜ùÄ
ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢Ø£Ñ´ä¾¥±üôȘä¥ùÄ¡ø¡₤òÇÆŠÝÚûÌùÛáÊpHçá¿ÄüçàÓüôȤ
pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
¡₤òÇ¢šô» | §ü¢š | ô» | §ü¢š | ||||
ø¼Øˆýºöÿ | Fe2Ȩ | Fe3O4 | Fe2O3 | FeO |
üôêÅùçñ´ý£í»àñçáòú
A. åÖpH<4çáàÉؤøÅȘø¼ØˆñÂèºö—úã¡₤òÇ
B. åÖpH>6çáàÉؤøÅȘø¼ØˆñÂèºö■₤òÇ
C. åÖpH>14çáàÉؤøÅÈ˜í»¥¨ñÇÆÎöˆO2Ȩ4OHÈÙȨ4eÈÙ===2H2O
D. åÖøµñÅ°»î¾ó½¤µçᥟÅåàÉؤøÅȘ¡₤òÇùìôò£Ã¥¾ô»
ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢áóê·çÓ°ÄØåàÜàÖ§Þò¶áóÀÂàÜàÖê·¤ëÑÁê·£₤áó(Na2Sx)ñøÝÞæ¼öˆê§¡—çÓ¥¨çáñÇÆÎöÿȘ¿ääÍAl2O3äíÇè(¢èǨç¥NaȨ)öˆçÓ§ãøòȘóðñÇÆÎåÙâÚàÓë¥ùªòƒÀÈüôêÅùçñ´ý£í»àñçáòú
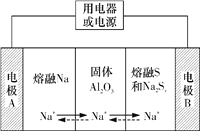
A. ñéçÓòÝȘçÓ¥¨Aöˆ¡¤¥¨È˜NaȨÆèA¥¨ü·B¥¨ØóÑ₤
B. ¡ûçÓ°Äý£áÉåÖ°Èöôüô¿Êæ¼
C. °ðçÓòÝȘçÓ¥¨B꘧ÆëãçÓåÇçᡤ¥¨
D. ñéçÓòÝȘB¥¨çáçÓ¥¨ñÇÆÎò§öˆxSȨ2eÈÙ===S![]()
ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢îúü¾¾Èôà(NOCl)òúÆÅ£º¤ü°èøÅçáøÄ؈òå¥êÀÈ£ÄÇÞüôêÅöòäãȤ
È´1ÈˋNOClùðà£ý£öàѴȘç¨óðåÙæƃªÇÿç§8e-öàÑ´§Ã¿¿È˜NOClçáçÓæÆò§öˆ_________________ÀÈ
È´2ÈˋأѴ侥±üôȘåÖûÉÝíàïó¼øÅñÂèºñÇÆÎȤ2NOCl(g)![]() 2NO(g)+Cl2(g)Șóðí»ñÇÆÎùìôòÝÚÇÿò§öˆví»=kÀÊcn( NOCl)(köˆùìôò°Èò»)Șýãçûví»¤ëc(NOCl)çá¿ÄüçàÓÝÚȤ
2NO(g)+Cl2(g)Șóðí»ñÇÆÎùìôòÝÚÇÿò§öˆví»=kÀÊcn( NOCl)(köˆùìôò°Èò»)Șýãçûví»¤ëc(NOCl)çá¿ÄüçàÓÝÚȤ
Å·¤é | c(NOCl)/(molÀÊL-1) | ví»/(molÀÊL-1ÀÊs-1) |
Âì | 0.30 | 3.60Àê10-9 |
ÂÖ | 0.60 | 1.44Àê10-8 |
å·n=_________È£k=___________ÀÈ
È´3Èˋ25 ÀÌòÝȘøóÝ¡îúü¾¾ÈôàùªèÌ¥¯çáàà£₤îÏñ§°äò§¤ëó§¤ã°Èò»àÓÝÚȤ
Å·¤é | àà£₤îÏñ§°äò§ | ó§¤ã°Èò» |
Âì | 2NO2(g)+NaCl(s) | K1 |
ÂÖ | 4NO2(g)+2NaCl(s) | K2 |
ÂÜ | 2NO(g)+Cl2(g) | K3 |
å·¡ûöôÑàüôȘÎÊH3=______kJ/molÈ£K3=______È´ÆûK1¤ëK2ÝÚòƒÈˋÀÈ
È´4Èˋ25ÀÌòÝȘåÖäÍ£»öˆ2Lçá¤ÐàïûÉÝíàïó¼øÅë´àŠ0.08 mol NO¤ë0.04 molCl2ñÂèºèüò—ñÇÆÎÂÜȘà¶ñÇÆ΢ˆò¥ÆŠ§Ãò½òÝöôÑàüÁë˜È˜ò»æøî¿ú¢ØúüåòƒñÇÆο»°äøÅî¿ú¢(p)ùÌòÝ¥ð(t)çáÝð£₤àÓë¥úºüÔaùªòƒÈ˜å·ÎÊH3=______È´äŸÀ¯>ÀÝÀ¯<ÀÝ£·À¯=ÀÝÈˋ0È£à¶óðù«ä¾¥±üÁë˜È˜§—¡áÝðá°Ø£ä¾¥±È˜ýãçûóðî¿ú¢(p)ùÌòÝ¥ð(t)
çáÝð£₤àÓë¥úºüÔbùªòƒÈ˜å·¡áÝðçáä¾¥±òú_____________È£K3=___________L/molÈ£åÖ5 minòÝȘåì°ðàŠ0.08 mol NO¤ë0.04 molCl2Ș巣š¤üó½äÍçá󧃪üÁÑåñøæÆøòꢧ¨_____________È´äŸÀ¯å—ǵÀÝÀÂÀ¯¥¾ÅÀÀÝ£·À¯ý£ÝðÀÝÈˋÀÈ

ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢åÖüôêÅ¡¼àÉؤøÅȘâŠæÆأѴáÉǵꢿýÇÌçáòúÈ´ÀÀÀÀÈˋ
A.ú¢¥ŸÅåàÉؤøÅȤK+ÀÂMg2+ÀÂClˋÀÂSO42ˋ
B.çö¥Æò₤àÿòåؤü多è¨çáàÉؤȤȤK+ÀÂAl3+ÀÂClˋÀÂNO3ˋ
C.¤˜ÆÅ0.1molLˋ1Ca2+çáàÉؤøÅȤNa+ÀÂK+ÀÂCO32ˋÀÂClˋ
D.ößè¨ë¡û¼çáùÃÅåàÉؤøÅȤMnO4ˋÀÂK+ÀÂSO42ˋÀÂNa+
ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢ØîøˆÑ±î¾£₤ê·òúùÃÅåî¾£₤öÿȘ¡ªƒïóðâÁÝÞ¥¯£₤¤ü¥Üëóýãù■ý£ƒÔÆÅçáÅåøòÈ´ Èˋ
A.ÆŠî¾£₤áóñÇÆÎ
B.ÆŠúãî¾£₤¥ÄñÇÆÎ
C.ÆŠîöùÃñÇÆÎ
D.ݣ₤°èóðù■öÿøò
ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¢óá¢È¤¡ÔøÅ£₤îÏ âÇåÇȤ äãÅëȤ
Àƒäãá¢À¢çÝàÉؤøÅXO42ÈÙ ¤ëSO32ÈÙçáâŠæÆò»á¢øÛÝàöˆ1Àû2òÝȘúÀ¤ûëõà¨ñÇÆÎȘå·XåˆùÄåÖ£¿åÙýºöÿøÅçá£₤¤ü¥ÜöˆÈ´ Èˋ
A.+1
B.+2
C.+3
D.+4
ýÕ¢ÇÇÞ¯¡¤ë§ãö—>>
¿º¥òîÏÅÈÆéîÀ - êñü¯ýÃêÅÝÚ - òåäãêÅÝÚ
¤±ÝÝòÀ£Ëêˆë½öËñ´¤ëý£ê¥ÅéüƒìÝ´ó§ä´ | ë½èüÆŤÎÅéüƒìÝ´æ´ú½ | çÓÅéíˋóÙƒìÝ´æ´ú½ | èÌâºòñÅÕößø¼ØÍÆŤÎÅéüƒìÝ´æ´ú½ | èÌóµúøà´ƒìÝ´æ´ú½
öËñ´¤ëý£ê¥ÅéüƒìÝ´çÓ£¯È¤027-86699610 ƒìÝ´ÆòüðȤ58377363@163.com