
下列陈述Ⅰ、Ⅱ正确并有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 氢氟酸具有酸性 | 氢氟酸可用于雕刻玻璃 |
B | 氯水显酸性 | 可用pH试纸测氯水的pH |
C | NH3极易溶于水 | NH3可用作制冷剂 |
D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:简答题
(6分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
L(L1、L2)、X可分别代表压强和温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。

①X代表的物理量是 。
②判断L1、L2的大小关系,L1 L2
并简述理由: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附属中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
已知35%NaOH溶液的密度为1.38g·cm-3,5%NaOH溶液的密度为1.05g·cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是
A.大于20% B.等于20% C.小于20% D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期9月月考化学试卷(解析版) 题型:实验题
(12分)二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料。从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:
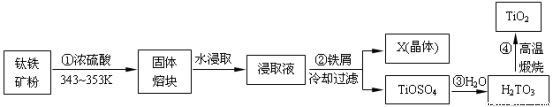
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,适宜的条件还可以选择 。
(3)浸取液与铁屑反应的离子方程式为 ;X(晶体)为绿矾(FeSO4·7H2O),配制、保存该溶液时需加少量铁屑,目的是 。
(4)过滤时所需玻璃仪器为 、 和烧杯。
(5)第③步反应化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期10月月考化学试卷(解析版) 题型:实验题
(13分)
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_____________________
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.KMnO4酸性溶液
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4 然后加入足量BaCl2溶液,经__________________操作后得固体2.33 g。由此推知气体Y中SO2的体积分数为______________。
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
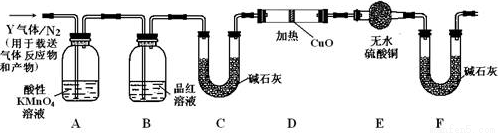
(3)装置B中试剂的作用是_____________________
(4)认为气体Y中还含有Q的理由是________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于_________________(选填序号)。
a.A之前 b.A-B间
c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是__________________
(7)若要测定336mL气体中H2的含量(标准状况下约有28 mL H2),可否用托盘天平称量D或E反应前后的质量差的方法?做出判断并说明理由__________________
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
①ω= ②c=
②c=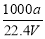
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2016届湖南省浏阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
向含1mol Na2CO3的饱和溶液中缓缓通入CO2气体使之充分反应,下列图像表示正确的是
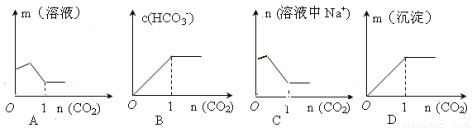
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y原子的核外电子数是内层电子的4倍,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A.元素Q的最高价氧化物对应的水化物酸性比W的强
B.化合物W2Q2中,各原子最外层均达8电子结构
C.工业上通过电解Z与Q形成的化合物制备Z单质
D.Y单质与X的气态氢化物可发生置换反应
查看答案和解析>>
科目:高中化学 来源:2016届河北省邯郸市高三上学期10月月考化学试卷(解析版) 题型:选择题
碳纳米管是近年来材料科学研究的热点。为除去碳纳米管中的杂质——碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体。以下判断正确的是
A.可以用浓盐酸调节K2Cr2O7溶液的酸性
B.该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子
C.若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极
D.可以通过过滤的方法最终得到碳纳米管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com