
【题目】原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是

A. 装置①研究的是电解CuCl2溶液,它将电能转化为化学能
B. 装置②研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e-= Fe2+
C. 装置③研究的是电解饱和食盐水,B电极发生的反应:2Cl--2e-=Cl2↑
D. 向装置④烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的是( )
①C(s)+ ![]() O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
②S(g)+O2(g)═SO2(g);△H3 S(s)+O2(g)═SO2(g);△H4
③CaO(s)+H2O(l)═Ca(OH)2(s);△H5 CaCO3(s)═CaO(s)+CO2(g);△H6 .
A.②
B.①②
C.①③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A焰色反应为黄色,B的一价阴离子的电子层结构与氩相同,请回答:
(1)元素符号:A___________,B___________;
(2)元素B的离子结构示意图为__________,B的单质常温下是____态
(3)A和B形成的化合物的化学式是___________,该化学式_________(选填“能”或“不能”)称为分子式,它是通过_________键形成的,属于_________化合物(选填“离子”或“共价”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 | 3.0×10﹣8 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为 .
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号,下同).
A.c(H+) B. ![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D. ![]() E.
E. ![]()
若该溶液升高温度,上述5种表达式的数据增大的是 .
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图: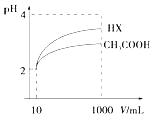
则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是 .
(4)已知100℃时,水的离子积为1×10﹣12 , 该温度下测得某溶液pH=7,该溶液显(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ下图为H2和Cl2生成HCl过程中的能量变化:

请回答下列有关问题:
(1)H2+Cl2═2HCl是_______(填“吸热”或“放热”)反应,反应物的总能量_______(填“>”,“=”或“<”)生成物的总能量;
(2)当有1molHCl生成时,反应_________(填“吸收”或“放出”)的能量为________KJ。
Ⅱ 一个完整的氧化还原反应方程式可拆写成两个半反应式,一个为氧化反应式,一个为还原反应式。
(1)已知某一反应的半反应式分别为CH4+10OH-—8e-=CO32-+7H2O和O2+2H2O+4e-=4OH-请写出该反应的总反应式:________________________。
(2)下图为氢氧燃料电池的构造示意图:

X极为电池的______________(填“正”或“负”)极,X极的电极反应式为_____________________;若电池工作过程中有5.6LO2(标准状况下)参与反应,则转移电子的物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.
2ClO2↑+K2SO4+2CO2↑+2H2O.
下列说法中错误的是( )
A.KClO3在反应中得到电子
B.ClO2中氯的化合价为+4价
C.在反应中H2C2O4是还原剂
D.1 mol KClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:

(1)仪器A的名称是_____________;实验前先将仪器按图连接好,然后_____________,再开始实验;
(2)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,解释放出氨气的原因________________;
(3)本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:_____________,这个反应说明氨气具有______________(填编号);
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________;
(5)在最后出气管口收集干燥纯净的氮气,收集方法是_________(填编号);
A.排空气法 B.排水法 C.用气囊收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 探究温度对平衡的影响 | 比较HCl、H2CO2和 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com