
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体。在M处观察到明显的实验现象。试回答以下问题:
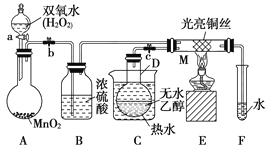
(1)写出A中发生反应的化学方程式:_____________________;B的作用是____________________;C中热水的作用是_________________________________________。
(2)写出M处发生反应的化学方程式为_________________________。
(3)从M管中可观察到的现象为_______________________,从中可认识到该实验过程中催化剂________(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应________(填“能”或“不能”)继续进行,其原因是_________________________________。
【答案】2H2O2![]() 2H2O+O2↑ 干燥O2 使D中乙醇变为蒸气进入M中参加反应 2CH3CH2OH+O2
2H2O+O2↑ 干燥O2 使D中乙醇变为蒸气进入M中参加反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 受热部分的铜丝由于间歇性地鼓入氧气而交替出现变黑、变红的现象 参加 温度 能 乙醇的催化氧化反应是放热反应,反应放出的热量能维持反应继续进行
2CH3CHO+2H2O 受热部分的铜丝由于间歇性地鼓入氧气而交替出现变黑、变红的现象 参加 温度 能 乙醇的催化氧化反应是放热反应,反应放出的热量能维持反应继续进行
【解析】
(1)A中是过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑;B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M,故答案为:2H2O2
2H2O+O2↑;B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M,故答案为:2H2O2![]() 2H2O+O2↑;干燥O2;使D中乙醇变为蒸气进入M中参加反应;
2H2O+O2↑;干燥O2;使D中乙醇变为蒸气进入M中参加反应;
(2)M处发生的反应是乙醇的催化氧化反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,
2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜,热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;催化剂参加反应过程,催化作用需要一定的温度,
故答案为:受热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;参加;
(4)如果撤掉酒精灯,反应能继续进行;因为 乙醇的催化氧化反应是放热反应,反应放出的热量维持反应继续进行


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
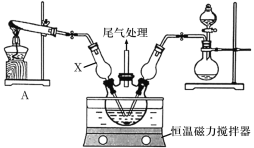
(1)仪器X的名称是______,其主要作用有导气、______。
(2)实验室利用装置A制NH3,发生反应的化学方程式为_______。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有_____。
(4)若体系中NH3过量会导致碱式氯化铜的产量___(填“偏高”、“偏低”或“无影响”),原因为___。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(5)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1。则称取的样品中 n(Cu2+)=_____mol。
(6)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂_____(填标号)。
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=_____mol。
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
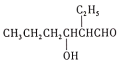
【题目】辛烯醛是重要化工原料,某小组拟用正丁醛制备辛烯醛并探究其结构。
[制备实验]
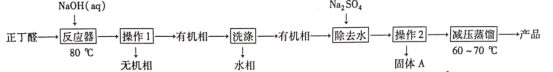
已知:①正丁醛的沸点为75.7℃。辛烯醛沸点为177℃,密度为0.848 g·cm-3,不溶于水。
②CH3CH2CH2CHO![]()
![]()
![]()
(1)在如图1三颈瓶中加入12.6 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入10 mL正丁醛。最适宜的加热方式是___________;使用冷凝管的目的是____________。
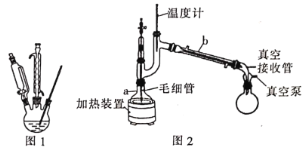
(2)操作1中使用的主要仪器名称是___________,有机相从___________(填“上”或“下”)口取出。
(3)判断有机相已洗涤至中性的操作方法:___________。
(4)操作2的名称是_____________;固体A的摩尔质量为322 g·mol-1,固体A的化学式为___________。
(5)利用图2装置进行“减压蒸馏”。下列有关说法错误的是___________。(填选项)
A 温度计示数为177℃,指示馏分温度
B 随着温度计液泡高度的提升,所得液体的沸点升高
C 毛细管的作用和沸石相似,防止液体暴沸
D 实验结束后,应先关闭冷凝水,再关闭真空泵
[性质实验]
资料显示:醛类(RCHO)在常温下能与溴水、酸性高锰酸钾溶液反应;在加热条件下能与银氨溶液、新制氢氧化铜浊液反应。
(6)为了证明辛烯醛含有碳碳双键,设计如下方案,能达到实验目的的是________。(填选项)
a 取少量溴水,滴加辛烯醛,振荡,溶液褪色
b 取少量酸性高锰酸钾溶液,滴加辛烯醛,振荡,溶液褪色
c 取少量辛烯醛,加入足量的银氨溶液,水浴加热充分反应后,冷却,在上层清液中先滴加稀盐酸酸化,再滴加溴水,振荡
d 取少量辛烯醛,加入足量的新制Cu(OH)2浊液,加热充分反应后,冷却,在上层清液中先滴加稀盐酸酸化,再滴加溴水,振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用亚硫酸盐(X)吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数(δ)与溶液pH的变化关系如图所示。下列说法中不正确的是( )
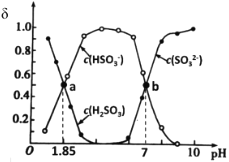
A.若X为(NH4)2SO3,图中b点溶液中n(HSO![]() )∶n(NH
)∶n(NH![]() )=1∶3
)=1∶3
B.若X为Na2SO3,当吸收液呈中性时:lgc(HSO![]() )-lgc(H2SO3)=5.15
)-lgc(H2SO3)=5.15
C.若X为(NH4)2SO3,(NH4)2SO3溶液呈碱性,说明水解程度:SO![]() >NH
>NH![]()
D.若X为Na2SO3,当吸收液pH=1.85时:c(Na+)=2c(HSO![]() )+c(SO
)+c(SO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次 增大。在如图所示的物质转化关系中,p、q、 m.n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1 ,t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
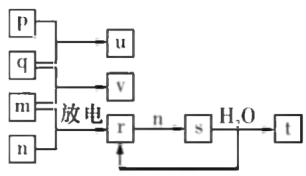
A.Y、W的兹高价氧化物对应的水化物均为强酸
B.元索的非金属性:Z>Y>X;原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25°C时,向a mL 0.10mol·L-1的HNO2溶液中逐滴加入0.10mol·L-1的NaOH溶液,滴定过程中,混合溶液的pOH[pOH= -lgc(OH-)]与NaOH溶液的体积V的关系如图所示。已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),下列说法不正确的是( )
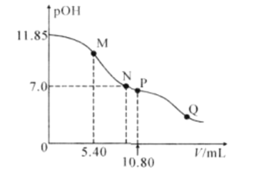
A.25°C时,HNO2电离常数的数量级是10-4
B.M点溶液中存在:3c(H+)+ c(HNO2)=3c(OH-)+ c(NO2-)
C.图上M、N、P、Q四点溶液中所含离子的种类相同
D.a=10.80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
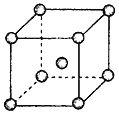
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种用于分离镧系金属的化合物 A(如下图所示),短周期元素 X、Y、Z原子序数依次增大,其 中 Z位于第三周期。Z与 Y2可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于 X、Y、Z的叙述,正确的是
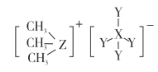
A.离子半径:Y >Z
B.氢化物的稳定性:X >Y
C.最高价氧化物对应水化物的酸性:X >Z
D.化合物 A中,X、Y、Z最外层都达到 8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.金属及其化合物在生产生活中有着广泛的应用,
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现_______性;_______(填“能”或“不能”)用氢氧化钠溶液代替。
(2)将Cu与稀硫酸混合,二者不能反应,滴入H2O2后,溶液很快变成蓝色,该反应的化学方程式为____________________________________________。
(3)NaHSO4是一种酸式盐,写出NaHSO4在水中的电离方程式_________________________。
II.物质的量是学习化学的基础。
(1)14.4 g CO和CO2的混合气体在标准状况下所占的体积为8.96 L,其中CO的质量为_____。
(2)市售浓H2SO4的质量分数为98%、密度为1.84g/cm3,其浓度为________mol·L-1。
(3)19g某二价金属的氯化物ACl2中含有0.4mo1Cl-离子,金属A的相对原子质量是_______。
(4)根据反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,可知当有2.5 mol FeS2参加反应时,被氧化的硫的物质的量为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com