
 ;
; ;写出反应⑦的化学方程式
;写出反应⑦的化学方程式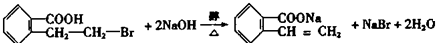 ;
;
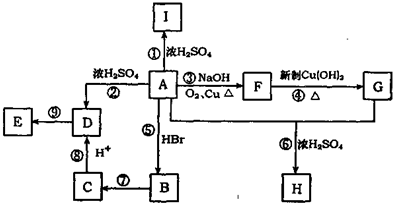
分析 A能发生连续的氧化反应,说明结构中含有-OH,A为只含有C、H、O三种元素的芳香烃衍生物,且芳环上只有两个取代基,A中含有苯环,A在浓硫酸作用下生成的I中除含有一个苯环外还含有一个六元环,应是发生的酯化反应,A中含有羧基,A连续被氧化生成G,碳原子个数不变,所以H中碳原子个数为A、G碳原子个数之和,且二者碳原子个数相等,所以A中含有9个碳原子,I中六元环知,A的结构应为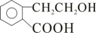 ;
;
根据题给信息知,A与HBr反应生成B,发生的为取代反应,B为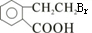 ,E为高分子化合物,应由D发生加聚反应生成,D中含有C=C键,由A在浓硫酸作用下发生消去反应生成,则D为
,E为高分子化合物,应由D发生加聚反应生成,D中含有C=C键,由A在浓硫酸作用下发生消去反应生成,则D为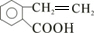 ,E为
,E为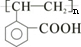 ,I为
,I为 ,
,
由B→C→D可知,B在氢氧化钠的醇溶液中发生消去反应生成C,C酸化后生成D,则C应为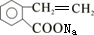 ,A连续被氧化生成G,则F为醛,G为酸,F为
,A连续被氧化生成G,则F为醛,G为酸,F为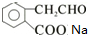 ,G为
,G为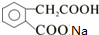 ,据此分析解答.
,据此分析解答.
解答 解:A能发生连续的氧化反应,说明结构中含有-OH,A为只含有C、H、O三种元素的芳香烃衍生物,且芳环上只有两个取代基,A中含有苯环,A在浓硫酸作用下生成的I中除含有一个苯环外还含有一个六元环,应是发生的酯化反应,A中含有羧基,A连续被氧化生成G,碳原子个数不变,所以H中碳原子个数为A、G碳原子个数之和,且二者碳原子个数相等,所以A中含有9个碳原子,I中六元环知,A的结构应为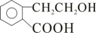 ;
;
根据题给信息知,A与HBr反应生成B,发生的为取代反应,B为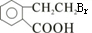 ,E为高分子化合物,应由D发生加聚反应生成,D中含有C=C键,由A在浓硫酸作用下发生消去反应生成,则D为
,E为高分子化合物,应由D发生加聚反应生成,D中含有C=C键,由A在浓硫酸作用下发生消去反应生成,则D为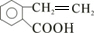 ,E为
,E为 ,I为
,I为 ,
,
由B→C→D可知,B在氢氧化钠的醇溶液中发生消去反应生成C,C酸化后生成D,则C应为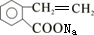 ,A连续被氧化生成G,则F为醛,G为酸,F为
,A连续被氧化生成G,则F为醛,G为酸,F为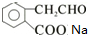 ,G为
,G为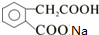 ,
,
(1)A为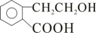 ,分子式为C9H10O3,I为
,分子式为C9H10O3,I为 ,故答案为:C9H10O3;
,故答案为:C9H10O3; ;
;
(2)反应②为消去反应,反应⑤为:取代反应,反应⑨为加聚反应,
故答案为:消去反应;取代反应;加聚反应;
(3)反应⑥是酯化反应,所以该反应中浓H2SO4的作用是催化剂、脱水剂,故答案为:催化剂、脱水剂;
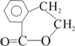
(4)反应④的化学方程式为 ;
;
反应⑦的化学方程式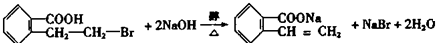 ,
,
故答案为: ;
;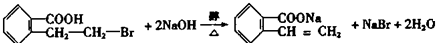 ;
;
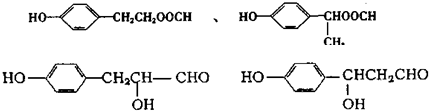
(5)A为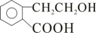 ,A的同分异构体符合下列条件:
,A的同分异构体符合下列条件:
①分子中有两个对位取代基,说明苯环上含有两个取代基且处于对位;
②与FeCl3溶液能发生显色反应,说明含有酚羟基;
③能发生银镜反应,说明含有醛基,
则符合条件的同分异构体有 (任写两种即可),
(任写两种即可),
故答案为: (任写两种即可).
(任写两种即可).
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据某些物质的分子式、反应条件进行推断,正确判断A结构简式是解本题关键,难点是(5)同分异构体种类判断.


科目:高中化学 来源: 题型:选择题

| A. | Fe电极作阳极,发生氧化反应 | |
| B. | Cl-向石墨极作定向运动 | |
| C. | 石墨电极反应:Fe3++3e-═Fe | |
| D. | 电解池发生总反应:2Cl${\;}_{\;}^{-}$+2Fe3+═Cl2+2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①溶液逐渐变红色的原因是Fe2+被酸性KMnO4溶液氧化 | |
| B. | ②红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化 | |
| C. | ②红色逐渐褪去的原因是酸性KMnO4溶液将Cl-氧化 | |
| D. | ③溶液又逐渐变色且为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 | |
| B. | 常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA | |
| C. | 将0.1molCl2通入1L水中,转移的电子数为0.1NA | |
| D. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,1.8g H2O含有0.2nA个H-O共价键 | |
| B. | 1L 0.3 mol•L-1的FeCl3溶液中Fe3+数目为0.3nA | |
| C. | 标准状况下,22.4L CCl4中含 nA个CCl4分子 | |
| D. | 标准状况下,22.4L NO2和CO2的混合气体含有2nA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
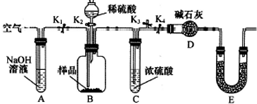 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.
某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.硫酸/mol•L-1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com