
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
 )、氢氧化铝、碳酸钙、青霉素这四种常见的药物中,属于抗生素的是
)、氢氧化铝、碳酸钙、青霉素这四种常见的药物中,属于抗生素的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
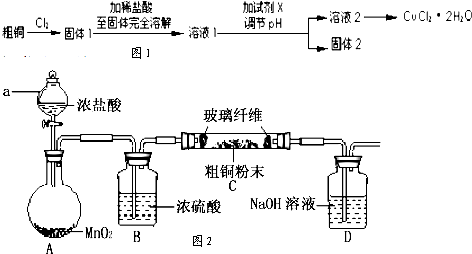
| 离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
2+ 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 2008年北京成功举办了第29届奥运会,兑现了绿色奥运承诺.试回答下列问题.
2008年北京成功举办了第29届奥运会,兑现了绿色奥运承诺.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com