
����Ŀ�����ܱ������з�����ӦX(g)��3Y(g)![]() 2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊ0.1mol��L��1��0.3mol��L��1��0.2mol��L��1����һ�������£�����Ӧ�ﵽһ����ʱ�������ʵ�Ũ�ȿ����ǣ� ��
2Z(g)����X��Y��Z����ʼŨ�ȷֱ�Ϊ0.1mol��L��1��0.3mol��L��1��0.2mol��L��1����һ�������£�����Ӧ�ﵽһ����ʱ�������ʵ�Ũ�ȿ����ǣ� ��
A. XΪ0.2 mol��L��1B. YΪ0.1 mol��L��1
C. ZΪ0.4 mol��L��1D. ZΪ0.1 mol��L��1ʱ��YΪ0.4 mol��L��1
���𰸡�B
��������
����Ӧ������Ӧ������У����ɵ�Z��Ũ��С��0.2 mol��L -1 ����ƽ��ʱZ��Ũ��С��0.4 mol��L -1 ������Ӧ���淴Ӧ�����ƶ������ɵ�X2 ��Y2 ��Ũ��С��0.1 mol��L -1��0.3 mol��L -1����ƽ��ʱX2��Ũ��С��0.2 mol��L -1 ��Y2 ��Ũ��С��0.6 mol��L -1 ��
A. ƽ��ʱX2��Ũ��С��0.2 mol��L��1��ѡ��A����
B. ƽ��ʱY��Ũ��С��0.6 mol��L -1������0������Ϊ0.1 mol��L��1��ѡ��B��ȷ��
C. ƽ��ʱZ��Ũ��С��0.4 mol��L��1 ��ѡ��C����
D. ZΪ0.1 mol��L��1ʱ��YΪ0.45mol��L��1��ѡ��D����
��ѡB��


 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ת����ϵ������ش��������⡣

(1)����X������______��A�Ļ�ѧʽ____________��
(2)д����Ӧ�٢ڢۢܵĻ�ѧ����ʽ
��____________________________________________________________________��
��____________________________________________________________________��
��___________________________________________________________________��
��___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2Fe2++Br2=2Fe3++2Br-��2Fe3++2I-=2Fe2++I2����FeI2��FeBr2�Ļ����Һ��ͨ������Cl2����Һ��ijЩ���ӵ����ʵ����仯����ͼ��ʾ������˵���У�����ȷ����

A. ��ԭ�ԣ�I->Fe2+>Br-
B. ԭ�����Һ��FeBr2�����ʵ���Ϊ6 mol
C. ԭ��Һ�У�n(Fe2+)��n(I-)��n(Br-)=2:1:3
D. ��ͨ��2mol Cl2ʱ����Һ���ѷ��������ӷ�Ӧ�ɱ�ʾΪ��2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������͵ķ�Ӧһ�������������ԭ��ص���
A.���ȷ�ӦB.���ӷ�ӦC.������ԭ��ӦD.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���ռ���ͭ��Ũ���ᷴӦ�����ɵ��������̽�����Իش���������
(1)��ͼ����ͭ��Ũ���ᷴӦ����ʵ��װ��
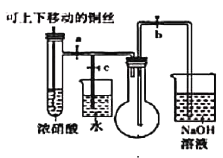
��ָ��װ���еĴ���_________________________��
��װ�øĽ���Ϊ��ʹ���ɵ����������ƿ��ʵ��ʱ�ȹرյ��ɼ�_______���ٴ��ɼ�________��
�۵����������ƿ��___________________________������ʹ��Ӧֹͣ��
(2)����ƿ�г�������ɫ������ʱֹͣʵ�飬ȡ����ƿ��������Ƥ����
�ٰ���ƿ������װˮ��ˮ���в�����ƿ����Ƥ������ƿ��ˮ�����������ݻ�ѧ����ʽ3NO2+H2O=2HNO3+NO������ƿ����Һ��Ũ����______mol/L(��������δ��ɢ��ˮ�ۣ��ҵ�ʱ�����������Ħ�����Ϊ25L/mol)
�ڰ���ƿ������װˮ��ˮ���в�����ƿ����Ƥ����ʵ��ʱ������ƿ��Һ����������������������ƿ���������������ԭ��������ռ���NO2�к���__________��
A.NO B.N2O4 C.O2 D.����
��С��ͬѧ�������Ϸ��֣�NO2����ˮʱ����������������2NO2+H2O=HNO3+HNO2��Ϊ��֤���������ʣ�������ٵ���Ҫԭ��С��ͬѧ����ƿ�е���Һ�μӸ��������Һ�����ָ��������Һ��ɫ��д�����������Һ��ɫ�����ӷ���ʽ____________________________��
(3)HNO2��һ�ֲ��ȶ��ֽ�������.2HNO2=NO��+NO2��+H2O����.3HNO2=HNO3+2NO��+H2O��Ϊ��̽����ͬ�¶ȡ�Ũ����������ķֽ���С��ͬѧ��������ʵ�飺
��һ��������1mol/LNaNO2��Һ100mL(��Ϊ��ҺA)��
�ڶ�����ȡ��ҺA�ֱ��ˮϡ��Ϊ0.5mol/L��0.2mol/L��0.1mol/L����Һ�����α�Ϊ��ҺB��C��D��
���������ֱ�ȡ���ι���ҺA~D��Һ���Թ��У�������Ƥ�������ڲ�ͬ�¶ȵ�ˮ�м���5min���ټ���һ�ι�10mol/LH2SO4��Һ������������Ƥ�����۲������������ɫ
ˮԡ�¶�/�� | A | B | C | D |
��ˮԡ | ����ɫ | ����ɫ | ����ɫ | ����ɫ |
80-70 | ����ɫ | ����ɫ | ����ɫ | ��ɫ |
50-40 | ����ɫ | ��Һ���Ϻ���ɫ | ��ɫ | ��ɫ |
20-10 | ��Һ���Ϻ���ɫ | ��ɫ | ��ɫ | td style="width:88.95pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">
�ٵ�һ��ʵ��Ҫ�õ����������У��ձ���100mL����ƿ����������___________��
����NaNO2��Һ���������ֱ����HNO2��Һ��ԭ����______________��
��ͨ��ʵ������ó����ۣ�____________�����£������ᰴ��Ӧ�����ֽ⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 24 g þ��27 g���У�������ͬ��������
B. ͬ�������������ͳ����У���������ͬ
C. 1 mol��ˮ��1 molˮ�У���������Ϊ2��1
D. 1 mol�����1 mol��ϩ�У���ѧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������ȼ�ϵ����һ�����͵�ȼ�ϵ�أ��乤��ԭ����ͼ��ʾ�����е������Һ��KOH��Һ��������ӦʽΪO2��2H2O��4e��===4OH����������������⣺
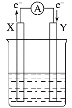
��ͨ������ĵ缫��___(����������������)����
��Al�缫��___(����X������Y��)�缫��
�۵���ܷ�ӦʽΪ______(д���ӷ���ʽ)��
��2�����켼����ʹ�õ�����ȼ�ϵ�ؾ��и��ܣ���������Ⱦ���ŵ㡣����ȼ�ϵ������ʽ�ͼ�ʽ���֣����Ƿŵ�ʱ�ĵ���ܷ�Ӧʽ��Ϊ2H2��O2===2H2O��
����ʽ����ȼ�ϵ�صĵ������Һ��ϡ���ᣬ�为����ӦʽΪ2H2��4e��===4H��������������ӦʽΪ______��
�ڼ�ʽ����ȼ�ϵ�صĵ������Һ��KOH��Һ�����为����ӦʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1-�������һ����Ҫ���л��ϳ��м��壬�е�Ϊ71�����ܶ�Ϊ1.36 g��cm-3��ʵ�����Ʊ�����1-��������Ҫ��������:
����1:������A�м��������ӡ�12 g��������20 mLˮ����ˮ��ȴ�»�������28 mLŨH2SO4;��ȴ�������������¼���24 g NaBr��
����2:��ͼ��ʾ�ʵ��װ��������������ֱ������״�����Ϊֹ��
����3:�����Һת���Һ©�����ֳ��л��ࡣ
����4:���ֳ����л���ת���Һ©����������12 mL H2O��12 mL 5% Na2CO3��Һ��12 mL H2Oϴ������Һ���ôֲ�Ʒ����һ���ᴿ��1-����顣

��1������A��������_____________;���������ӵ�Ŀ���Ƿ�ֹ���к�___________________��
��2����Ӧʱ���ɵ���Ҫ�л���������2-������__________________________________��
��3������2���������ƿ�ڼ���������ˮ�����ڱ�ˮԡ�е�Ŀ����___________________��
��4������2���軺������ʹ��Ӧ������ƽ�Ƚ�����Ŀ����______________________________��
��5������4����5%Na2CO3��Һϴ���л���IJ���: ���Һ©����С�ļ���12 mL 5% Na2CO3��Һ������____________����������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���Ԫ�ر���������
A. FeS+2HCl��FeCl2+H2S�� B. Fe+H2S04��FeS04+H2��
C. FeO+2HCl��FeCl2+H20 D. Fe203+3CO![]() 2Fe+3C02
2Fe+3C02
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com