
【题目】据下图的转化关系及现象回答下列问题。

(1)固体X的名称______;A的化学式____________。
(2)写出反应①②③④的化学方程式
①____________________________________________________________________;
②____________________________________________________________________;
③___________________________________________________________________;
④___________________________________________________________________。
【答案】过氧化钠 CO2 2Na2O2+2CO2═2Na2CO3+O2 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 2Na+O2![]() Na2O2 CaCO3+2HCl═CaCl2+CO2↑+H2O
Na2O2 CaCO3+2HCl═CaCl2+CO2↑+H2O
【解析】
由转化关系可以知道淡黄色固体为Na2O2,则A为CO2,B为O2,金属单质为Na,固体Y为Na2CO3,白色沉淀为CaCO3,
(1)由以上分析可以知道X为过氧化钠,A为CO2;
(2)①为Na2O2和CO2的反应,反应的方程式为2Na2O2+2CO2═2Na2CO3+O2,
②为Na2CO3和澄清石灰水的反应,反应的方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,
③为Na和O2的反应,反应的方程式为2Na+O2![]() Na2O2;
Na2O2;
④为碳酸钙和盐酸的反应,反应的方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O,


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.2 g·mL-1,其中镁离子的质量分数为5.0%。300 mL该溶液中Cl-的物质的量约为( )
A. 0.37 mol B. 0.63 mol C. 0.74 mol D. 1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 食用用“瘦肉精”喂养的猪肉对人体无害
B. 塑料袋使用方便,但是会造成“白色污染”,应减少使用
C. 工业废水,生活污水不用处理达标,可随意排放
D. 可以随意抛弃废旧电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有研究人员发现了一种处理高浓度乙醛废水的新方法——隔膜电解法,实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,采用如图所示装置电解,电解后乙醛转化为乙醇和乙酸。则下列说法不正确的是( )
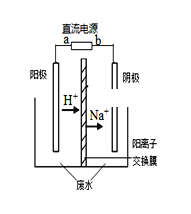
A. 阳极产物为乙酸,发生氧化反应
B. 电解时,阳极区附近pH 增大
C. 阴极反应式为CH3CHO+2H++2e-=CH3CH2OH
D. 若以CH4一空气燃料电池为直流电源,则燃料电池的a 极应通入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决大气污染的有效途径之一。燃料电池由于能量转化率高.可作为常规能源的替代品而越来越受到关注。
(1)直接甲醇燃料电池(简称DMFC)结构简单、对环境无污染,其工作原理如图所示。
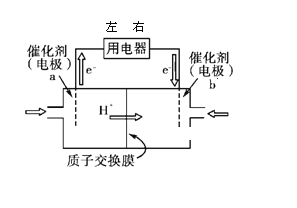
① 外电路电子从用电器_____(填“左端”、或“右端”)进人,b 极电极反应式为______;
② 有1.5mol电子通过用电器,则消耗的甲醇质量为______。
(2)一种用于驱动潜艇的液氨-液氧燃料电池的原理如图所示。
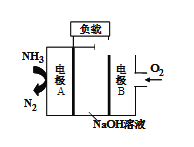
①电极B发生_______(填“氧化”或 “还原”)反应,电池工作时,OH-移向_____(填“A极”或“B极”)。
②电极A的电极反应式为____________。
(3)赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S == 6Cu+SO2↑在该反应中,氧化剂是:___________ 还原剂是:___________ 每当有0.3mol电子通过时,生成的铜的物质的量为 ___________mol 生成的SO2 在标况下的体积为_________ L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1和0.2mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是( )
2Z(g),若X、Y、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1和0.2mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是( )
A. X为0.2 mol·L-1B. Y为0.1 mol·L-1
C. Z为0.4 mol·L-1D. Z为0.1 mol·L-1时,Y为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com