
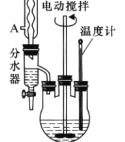
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得,反应装置如图(部分装置省 略),反应原理如下:
 +C2H5OH
+C2H5OH +H2O
+H2O
实验操作步骤:
向三颈烧瓶内加入12.2g 苯甲酸、25mL乙醇、20mL 苯及4mL浓硫酸,摇匀,加入沸石。
①装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒 中,继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
②将反应液倒入盛有80mL冷水的烧瓶中,在搅拌下分批加入碳酸钠粉末溶液至溶液无二氧化 碳逸出,用 pH 试纸检验至中性。
③用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水CaCl2干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接受210-213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8mL。
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
苯甲酸乙酯 | 150 | 1.05 | 211-213 | 微溶于热水,易溶于乙醇、乙醚 |
乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
乙醚 | 74 | 0.73 | 34.5 | 微溶于水 |
(1)反应装置中分水器上方的仪器名称是_______,其作用是______。
(2)步骤①中加入浓硫酸的作用是______,步骤②中电动搅拌棒的作用是_______。
(3)步骤②中使用分水器除水的目的是______。
(4)步骤③中加入碳酸钠的目的是______。
(5)有机层从分液漏斗的_______(选填“上口倒出”或“下口放出”span>)
(6)本实验所得到的苯甲酸乙酯的产率是_______。
【答案】(球形)冷凝管 冷凝回流,减少反应物乙醇的损失 作催化剂 使反应液受热均匀 及时分离出水,促进反应正向进行,提高产率 除去硫酸及为反应的苯甲 上口倒出 89.6%
【解析】
(1)反应装置中分水器上方的仪器名称是(球形)冷凝管,作用是:冷凝回流,减少反应物乙醇的损失;
(2)由反应方程式: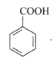 +C2H5OH
+C2H5OH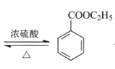 +H2O可知,浓硫酸的作用是催化剂;步骤②中电动搅拌棒的作用是使反应液受热均匀;
+H2O可知,浓硫酸的作用是催化剂;步骤②中电动搅拌棒的作用是使反应液受热均匀;
(3)由反应方程式: +C2H5OH
+C2H5OH +H2O可知,分水器及时分离出水,促进反应正向进行,提高产率;
+H2O可知,分水器及时分离出水,促进反应正向进行,提高产率;
(4)苯甲酸乙酯中混有未除净的苯甲酸和作催化剂的浓硫酸,两者都是杂质,加入碳酸钠可以除去;
(5)乙醚的密度是0.73 g·cm-3,密度比水小,萃取后在分液漏斗上层,上层液体从上口倒出;
(6)实验的产率= ![]() ×100%。
×100%。
(1)反应装置中分水器上方的仪器名称是(球形)冷凝管,作用是:冷凝回流,减少反应物乙醇的损失;
(2)由反应方程式: +C2H5OH
+C2H5OH +H2O可知,浓硫酸的作用是催化剂;步骤②中电动搅拌棒的作用是使反应液受热均匀;
+H2O可知,浓硫酸的作用是催化剂;步骤②中电动搅拌棒的作用是使反应液受热均匀;
(3)由反应方程式: +C2H5OH
+C2H5OH +H2O可知,分水器及时分离出水,促进反应正向进行,提高产率;
+H2O可知,分水器及时分离出水,促进反应正向进行,提高产率;
(4)苯甲酸乙酯中混有未除净的苯甲酸和作催化剂的浓硫酸,两者都是杂质,加入碳酸钠的目的是:除去硫酸及为反应的苯甲酸;
(5)乙醚的密度是0.73 g·cm-3,密度比水小,萃取后在分液漏斗上层,上层液体从上口倒出;
(6)12.20g苯甲酸的物质的量为:![]() =0.1mol,理论上生成苯甲酸乙酯为0.1mol,而生成苯甲酸乙酯的质量为:12.8mL×1.05gml1=13.44g,物质的量为:
=0.1mol,理论上生成苯甲酸乙酯为0.1mol,而生成苯甲酸乙酯的质量为:12.8mL×1.05gml1=13.44g,物质的量为:![]() =0.0896mol,所以实验的产率=
=0.0896mol,所以实验的产率= ![]() ×100%=
×100%= ![]() ×100%=89.6%,故答案为89.6%。
×100%=89.6%,故答案为89.6%。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.HF在水溶液中的电离方程式:HF+H2O![]() F-+H3O+
F-+H3O+
B.向0.1 mol·L-1氨水中加入少量水,溶液中![]() 减少
减少
C.将NH4Cl溶液从20℃升温至30℃,溶液中![]() 增大
增大
D.CH3COOK水解的离子方程式:CH3COO-+H2O=CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.气态电中性基态原子失去电子转化为气态基态正离子需要的最低能量叫做第一电离能
B.当碳原子的核外电子排布由![]() 转变为
转变为![]() 时,碳原子要向外界环境吸收能量
时,碳原子要向外界环境吸收能量
C.电负性的大小也可以作为判断金属性和非金属性强弱的尺度
D.同主族元素从上到下第一电离能逐渐变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,它的性质或用途,其物理性质与NaCl极为相似.相关化学性质如图所示,下列说法不正确的是( )

A. NaNO2稳定性大于NH4NO2 B. NaNO2与N2H4反应中,NaNO2是氧化剂
C. 可用KI淀粉和食醋鉴别NaNO2和NaCl D. 分解NaN3盐每产生1mol N2转移6mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
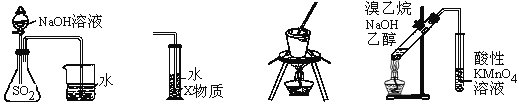
① ② ③ ④
A. 装置①可用于证明SO2与NaOH溶液发生了反应
B. 若装置②中X为CCl4,可用于吸收氨气或氯化氢
C. 装置③可用于实验室从食盐水中提取氯化钠
D. 装置④可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图实验装置进行实验不能达到目的是( )
选项 | 反应及实验目的 | 试剂X | 试剂Y |
|
A | 电石与饱和食盐水混合,检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 | |
B | 二氧化锰与浓盐酸混合加热,验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 | |
C | 乙醇与浓硫酸加热至170℃,证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 | |
D | 乙酸溶液与碳酸钠固体混合,探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解无关的正确说法是
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A.①④⑦B.全有关C.②⑤D.③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和![]() 的某些性质及相关键能如下表所示,下列说法不正确的是
的某些性质及相关键能如下表所示,下列说法不正确的是
表一
分子 | 熔点 | 沸点 | 常温时在水中的溶解度 |
CO |
|
|
|
|
|
|
|
表二
碳氮键 |
|
|
|
键能 |
|
|
|
氮氮键 |
|
|
|
键键能 | 193 | 418 | 946 |
A.CO与![]() 的价电子总数相等
的价电子总数相等
B.由表2可知,CO的活泼性不及![]() ,因为
,因为![]() 的键能大于
的键能大于![]()
C.由表1可知,CO的熔沸点高于![]() ,因为CO分子间作用力大于
,因为CO分子间作用力大于![]()
D.由表1可知,室温时CO在水中的溶解度大于![]() ,因为CO是极性分子
,因为CO是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用CO2和H2反应合成二甲醚,反应的热化学方程式为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ/mol。请回答:
①一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填序号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的n(CO2)/n(H2)值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=________;KA、KB、KC三者的大小关系是_____________。
③上述合成二甲醚的过程中,提高CO2的转化率可采取的措施有_______________ (任写两种)。
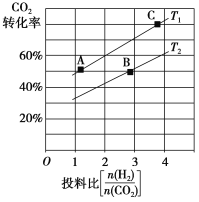
(2)用氨水吸收CO2可得到NH4HCO3溶液。若常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,在NH4HCO3溶液中,c(NH4+)________c(HCO3-)(填“>”、“<”或“=”),试计算常温下反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
NH3·H2O+H2CO3的平衡常数K=___________;NH4HCO3溶液中物料守恒表达式为_________。
(3)绿色“二甲醚燃料电池”在酸性溶液中负极的电极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com