
【题目】下列叙述中正确的是
A. 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
B. 配制硫酸溶液时先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
C. 在含有1mol Fe(OH)3的胶体中,有NA个Fe(OH)3胶粒
D. 胶体的电泳实验可证明某些胶体带电
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为;
(3)写出步骤③发生反应的离子方程式;
(4)步骤⑥的实验操作为、过滤、烘干.
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN﹣被过量的氧化剂氧化所致.现给出以下试剂:1.0mol/L硫酸、1.0mol/LNaOH溶液、0.1mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合趣实验验证乙同学的猜测是否合理.简要说明实验步骤和现象 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金橘中含有一种化合物H,它是一种香料,可用如下路线合成: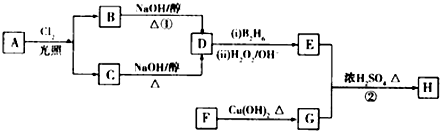
已知:Ⅰ:R﹣CH═CH2![]() RCH2CH2OH(B2H6为乙硼烷).
RCH2CH2OH(B2H6为乙硼烷).
Ⅱ:F的结构简式为 ![]() 回答下列问题:
回答下列问题:
(1)22.4L(标准状况)的烃A在氧气中充分燃烧可以产生176g CO2和90g H2O.A的分子式是 .
(2)B和C均为一氯代烃,且B分子的核磁共振氢谱图中只有一个吸收峰,则B的名称为 . (用系统命名法命名)
(3)反应①的反应类型是 . F中的含氧官能团的名称是;
(4)反应②的化学方程式为 .
(5)已知K是满足下列条件的G的同分异构体,则K的结构简式为 . a.属于具有与G相同官能团的芳香类化合物;
b.苯环上有两个取代基,且苯环上的一氯取代有两种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2L的密闭容器中充入2molPCl3(g)和1molCl2(g),发生反应:PCl3(g)+Cl2(g)PCl5(g),5min达平衡,容器中的压强为开始时的 ![]() ,并且放出37.2kJ的热量,请回答下列问题:
,并且放出37.2kJ的热量,请回答下列问题:
(1)前5min内,v(Cl2)=molL﹣1min,此温度下,平衡常数K= .
(2)下列哪个图象能正确说明上述反应在进行到t1时刻时,达到平衡状态 . 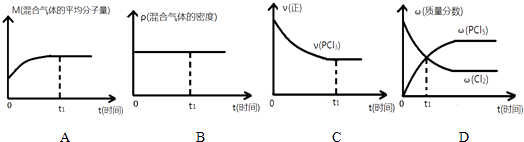
(3)平衡后,从容器中移走0.4molPCl3 , 0.2molCl2和0.2molPCl5 , 则平衡(填“正向移动”“逆向移动”或“不移动”),c(PCl3)(填“增大”“减小”或“不变”).
(4)相同条件下,若起始时,向2L的密闭容器中充入1molPCl3(g)和1molPCl5(g),反应达平衡后,理论上吸收 kJ的热量.
(5)PCl5与足量的水能完全反应生成H3PO4和HCl,将反应后的混合液逐滴加入到过量的Na2CO3溶液中,请写出可能发生反应的离子方程式 . (已知:H3PO4的电离平衡常数:Ka1=7.52×10﹣3 , Ka2=6.23×10﹣8 , Ka3=2.2×10﹣13;H2CO3的电离平衡常数:Ka1=4.3×10﹣7 , Ka2=5.61×10﹣11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌粉与碘粉混和均匀置于平底烧瓶中,向其中滴几滴水,看见有紫红色的蒸气,该蒸气是__,产生该气体的现象叫做___,说明锌粉与碘的反应为__(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物界在基本组成上的高度一致性表现在( )。
①组成生物体的主要化学元素的种类基本一致 ②各种生物的核酸都相同
③构成核酸的碱基都相同 ④各种生物的蛋白质都相同
⑤构成蛋白质的氨基酸都相同
A.①②④ B.①②③ C.③④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
I.CuSO4·5H2O的制取

(1)向含铜粉的稀硫酸中滴加少量稀硝酸(可加热),铜粉溶解时可以观察到的实验现象:____。
(2)根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为__________。
(3)步骤I、步骤II的操作名称分别是____、_____。
II.利用生产硼砂的废渣硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:

(4)实验室进行操作I、操作II所需的玻璃仪器有烧杯、______。滤渣I的成分是_____。
(5)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式__________。
(6)滤渣2的主要成分有MnO2和Fe(OH)3,写出生成MnO2的离子方程式_________。
(7)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为短周期主族元素,其原子序数依次增大。A、B 两元素最高正价和最低负价之和为零。E和A同主族; D、F是地壳中含量最高的非金属元素和金属元素。
(1)写出C元素的元素名称____,其在周期表中的位置_______________。E离子结构示意图为______________;E2D2的电子式______________。
(2)由A、C以原子个数比为5:1组成的一种化合物,其中各原子均达到稳定结构,该化合物中所含化学键类型为______________。
(3)F的最高价氧化物和C 的最高价氧化物对应的水化物反应的离子方程式为______________。
(4)由C、E 组成的一种离子化合物化学式为E3C,该化合物中两种离子的半径大小关系是______>______;该化合物遇水剧烈反应,该反应的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com