
【题目】有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)A2B的电子式__________;A2B2的电子式__________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如右图所示)。在b电极上发生的反应可表示为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为__________。

(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中,溶液由黄色逐渐变为浅绿色,该反应的离子方程式为________________________________________。
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池(右图),则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。石墨除形成原电池的闭合回路外,所起的作用还有:________________________________________。

【答案】 ![]()
![]() Pb-2e-+SO42-=PbSO4 Fe+2Fe3+=3Fe2+ 2Fe3++2e-=2Fe2+ 充当正极材料,形成原电池,氧还分开进行
Pb-2e-+SO42-=PbSO4 Fe+2Fe3+=3Fe2+ 2Fe3++2e-=2Fe2+ 充当正极材料,形成原电池,氧还分开进行
【解析】有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物,可以推断,B为O元素,则A为H元素,C为S元素,则D为Cl元素。
(1)H2O的电子式为![]() ;H2O2的电子式为
;H2O2的电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,b电极发生还原反应,则a电极发生还原反应,Pb失去电子生成PbSO4,负极电极反应式为:Pb-2e-+SO42-=PbSO4,反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,故答案为:Pb-2e-+SO42-=PbSO4;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,Fe为负极,失去电子生成Fe2+,负极电极反应式为:Fe-2e-=Fe2+,石墨为正极,Fe3+离子在正极获得电子生成Fe2+,正极电极反应式为:2Fe3++2e-=2Fe2+;比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是:充当正极材料,形成原电池、使还原反应和氧化反应在电解质溶液中的不同区域内发生,故答案为:2Fe3++2e-=2Fe2+;充当正极材料,形成原电池、使还原反应和氧化反应在电解质溶液中的不同区域内发生。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu == 2Fe2++ Cu2+。下列有关说法错误的是
A.Cu是还原剂,被腐蚀 B.Fe3+是氧化剂
C.该反应是置换反应 D.该反应属于离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断中正确的是
A. 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B. 无法确定原溶液中是否存在Cl-
C. 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D. 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种气态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯,其中成路线如下图所示:

(1)A制备B的方程式为:______________________________
(2)B与钠反应的化学放出式为:______________________________,利用B与钠反应制备氢气,若制得1molH2需要B__________mol。
(3)物质B在空气中可以被氧气为C,此过程的方程式为____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图,图中圆括号表示加入适当的试剂,编号表示适当的分离方法。

①写出加入的试剂(a)是__________,(b)是__________。
②写出有关的操作分离方法:①是__________,②是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 蛋白质是生命活动的主要承担 B. 蛋白质只含有C、H、O、N四种元素
C. 蛋白质是一种高分子有机化合物 D. 蛋白质被消化的产物是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态。
(1)①在元素周期表中,元素X位于 区,元素Y位于第 周期第 族。
②Z所在周期中,第一电离能最大的元素是 (填元素名称)。
③X+的核外电子排布式为 。
④Y和W两元素最高价氧化物对应的水化物酸性较强的是 (填化学式)。
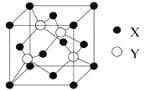
(2)X与Y所形成化合物晶体的晶胞如图所示。在1个晶胞中,X离子的数目为 ;该化合物的化学式为 。
(3)①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是 。
②稳定性: H2Z H2W(填“>”、“<”或“=”),其主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)互为同分异构体的四种有机物A、B、C、D,它们的相对分子质量为74,完全燃烧只生成CO2和H2O,经分析其含氧元素的质量分数为43.3%,则这些有机物的分子式为___________,
(2)已知A、B、C、D分子结构中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 |
A | 中和反应 | —— | 溶 解 | 产生氢气 |
B | —— | 有银镜 | 加热后有红色沉淀 | 产生氢气 |
C | 水解反应 | 有银镜 | 加热后有红色沉淀 | —— |
D | 水解反应 | —— | —— | —— |
则A、B、C、D的结构简式分别为
A____________ B____________ C____________ D____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 利用该技术可捕捉大气中的CO2
C. 每得到1mol草酸铝,电路中转移3mol电子
D. 正极的电极反应为:C2O42--2e-=2CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com