(2010?浙江)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H
2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H
2(g)?CH
3OH (g)△H
1(反应1)该反应的原料CO和H
2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+O2(g)=CO2(g)△H
2=-283kJ?mol
-1(反应2)
H2(g)+O2(g)=H2O(g)△H
3=-242kJ?mol
-1(反应3)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C≡O |
H-O |
| 键能/kJ?mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H
1=
-116kJ?mol-1
-116kJ?mol-1
.
(2)CH
3OH (g)燃烧生成CO
2(g)和H
2O(g)的热化学方程式为:CH
3OH(g)+
O
2(g)═CO
2(g)+2H
2O(g)△H
4 该反应的焓变△H
4=
-651kJ?mol-1
-651kJ?mol-1
.与CO和H
2相比,甲醇作为汽车动力燃料的优点是
单位体积供能多,密度大易于运输;单位产能耗氧量较少
单位体积供能多,密度大易于运输;单位产能耗氧量较少
.
(3)反应1的平衡常数表达式为
.为提高甲醇的产率,可以采取的措施有
降低温度、增加反应气体的压力、将反应生成的甲醇及时冷凝从反应体系中移去.
降低温度、增加反应气体的压力、将反应生成的甲醇及时冷凝从反应体系中移去.
(写出3点).既能提高产率,又能提高反应速率的措施是
增加反应气体的压强
增加反应气体的压强
.
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH
3OH(l)+
O
2(g)═CO
2(g)+2H
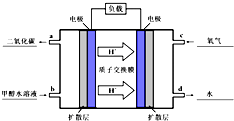
2O(l).其工作原理如示意图:

①在图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为
CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
.




 阅读快车系列答案
阅读快车系列答案




