

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
 。
。 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源:不详 题型:单选题
| A.电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程 |
| B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
| C.沉淀溶解达到平衡时,溶液中溶质的各离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
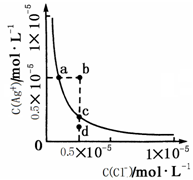
| A.加入NaCl可以使溶液由a点变到b点 |
| B.向AgCl饱和溶液中加入水, C(Ag+)增大 |
| C.d点无AgCl沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
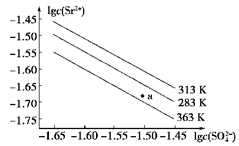
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
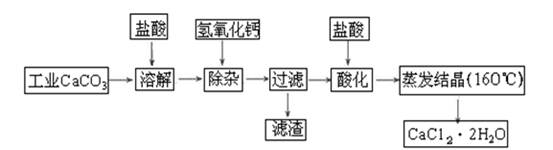 (1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
(1)除杂操作是加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________________
 ______________,
______________, 11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。
11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. 6; 6×10-7 mol·L-1 | B. 7; 1×10-5 mol·L-1 |
| C.7 ; 4×10-8 mol·L-1 | D. 6; 1× 10-5 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,沉淀的速率和溶解的速率相等
,沉淀的速率和溶解的速率相等查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 一元弱酸HA(aq)中存在下列电离平衡:HA
一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com