
【题目】下列晶体熔点最高的是( )
A. CO2 B. 金刚石 C. 晶体硅 D. H2O
科目:高中化学 来源: 题型:
【题目】美国《科学》杂志曾报道:在40 GPa的高压下,用激光加热到1800 K,人们成功制得了原子晶体CO2,下列对该物质的推断一定不正确的是( )
A. 该原子晶体中含有极性键 B. 该原子晶体易气化,可用作制冷材料
C. 该原子晶体有很高的熔点 D. 该原子晶体硬度大,可用作耐磨材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的元素是__________。
(2)最高价氧化物的水化物碱性最强的元素是__________。
(3)可用于制半导体材料的元素是_______。
(4)表中元素,只有负价没有正价的元素是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种新型结构材料,具有超硬、耐磨、耐高温等优良特性,下列各组物质熔化时,所克服的粒子间作用与氮化硼熔化时克服的粒子间作用都相同的是( )
A.硝酸钠和金刚石
B.晶体硅和水晶
C.冰和干冰
D.苯和萘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制氯气可用软锰矿和浓盐酸反应。
(1)写出该反应的离子方程式:_______________________________,若反应中生成11.2L的Cl2(标准状况),则被还原的盐酸的物质的量是______。
(2)实验室用下列两种方法制取氯气:①用含HCl 146g 的浓盐酸与足量的MnO2反应②用87g MnO2与足量的浓盐酸反应,则所得Cl2______。
A.①比②多 B.②比①多 C.一样多 D.无法比较
(3)实验室制氯气中收集干燥纯净的氯气可将气体先通过______,再通过______,氯气尾气吸收可用__________溶液,发生反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/( mol·L1) | 0.1 | 0.2 | 0 |
平衡浓度/( mol·L1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业利用氟磷灰石[Ca5(PO4)3F]生产磷铵[(NH4)3PO4]和白磷。其工艺流程如下图所示:

(1)氟磷灰石中磷元素的化合价为________,气体A 的电子式为________________;固体B 的化学式为____________________________。
(2)沸腾槽不能用陶瓷材质的原因是_______________________(用化学方程式表示)。
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500 ℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为____________________________。
(4)在装置I中通入过量氨气的目的是___________________________________________。
(5)磷铵与草木灰不能混合使用的原因是______________________________________。
(6) (NH4)3PO4溶液中含磷离子浓度的大小顺序是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
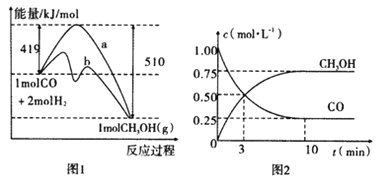
请回答下列问题:
(1)在“图1”中,曲线_________(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_____________。
CH3OH(g)的△H=_____________。
(2)下列说法正确的是__________。
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)=____________;达到平衡时,c(H2)=_________,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式___________________________________________________。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式___________________________________________________。
(5)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198,Cl—Cl :243,P—Cl:331。
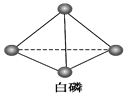
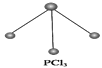
则反应P4(白磷,s)+6Cl2(g)![]() 4PCl3(s)的反应热ΔH=____________________。
4PCl3(s)的反应热ΔH=____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com